Denne blanding af gasser giver anledning til homogene blandinger eller gasformige opløsninger. For eksempel spredes de gasser, der kommer ud af fabriksskorstene, eller biludstødninger, gennem luften atmosfæriske, og med tiden var vi ikke i stand til at skelne dem mere, da der var en diffusion af disse gasser gennem luft.

De gasser, der udsendes af skorstenene, spredes og "taber" i den atmosfæriske luft, fordi luftmængden er meget større end røgens.
| DET diffusion af en gas er en spontan bevægelse af en gas gennem en anden, det vil sige dens spredning i et andet gasformigt medium. |
| DET effusion af gasser er en særlig type diffusion, hvor der er lækage af gasser gennem små huller (eller porøse vægge, som er et sæt små huller). |
For eksempel er balloner, der sælges til børn, fyldt med heliumgas. Over tid ender denne gas med at passere gennem ballonens gummiporer, det vil sige, at der er dens udstrømning. Det viser sig ved, at ballonen tømmes efter et par timer.
Den skotske kemiker Thomas Graham studerede i 1829 denne opførsel af gasser. Han konkluderede, at den hastighed, hvormed en gas diffunderer eller strømmer ud i en anden, er relateret til dens tæthed. Da hans eksperimentelle data blev gentaget for alle gasser, skabte han følgende lov, der bærer hans navn:
Grahams lov: hastigheden af diffusion eller effusion af en gas er omvendt proportional med kvadratroden af dens massefylde.
Matematisk kan denne lov udtrykkes ved ligningen:
v α 
Eller, relateret til to forskellige gasser, har vi:
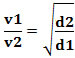
Den anvendte enhed i dette tilfælde er "volumen, der undslipper pr. tidsenhed"; derfor generelt L/min (liter i minuttet).
Således diffunderer gasser med lavere densitet hurtigere. Hvis den er i samme temperatur- og tryktilstand, kan man også lave en sammenhæng af dette med massen gasmolær: jo større densitet gassen er, jo større er dens molære masse og jo lavere er dens hastighed diffusion; og omvendt. Således har vi:
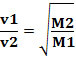
Af Jennifer Fogaça
Uddannet i kemi
Brasiliens skolehold
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm

