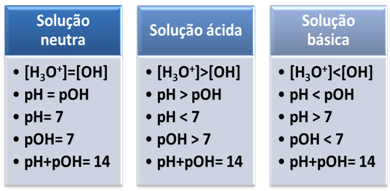
Et medium betragtes som neutralt, hvis det har samme koncentration, i mol/L, af hydroniumionerne (H3O+) og hydroxid (OH-).
Et eksempel på et neutralt medium, der endda fungerer som standard for andre opløsninger, er rent, destilleret vand ved en temperatur på 25ºC. Ved denne temperatur har den præcis 1. 10-7 mol/L af begge ioner. Derfor er dit ioniske produkt (Kw) er lig med 10-14 (mol/L)2:
Kw = [H3O+]. [åh-]
Kw = (1. 10-7 mol/L). (1. 10-7 mol/L) = 10-14 (mol/L)2
pH og pOH er angivet nedenfor:
pH= - log [H3O+] pOH= -log[OH-]
pH= - log 1. 10-7 pOH= - log 1. 10-7
pH = 7pOH = 7
Dette viser os, at i en neutral løsning pH er lig med pOH.
- Syre medium:
I et surt medium er koncentrationen af H-ioner3O+ er større end OH-ioners-.
En sådan løsning kan opnås ved at tilføje en lille del af H-ionerne3O+for eksempel ved hjælp af en syre.
Ifølge Le Chateliers princip, når en forstyrrelse forårsages af et system i ligevægt, har det en tendens til at justere sig selv for at reducere virkningerne af denne kraft. Det betyder, at hvis en syre tilsættes vand, vil H-ionerne
3O+ de vil være i overskud, og balancen vil skifte i den modsatte reaktionsretning, til venstre. Så disse overskydende ioner vil reagere med OH-ionerne-. Således er koncentrationen af OH-ioner- vil falde, og opløsningen bliver sur.
Det ioniske produkt (Kw) er altid lig med 10-14, men koncentrationen af H-ioner3O+ er større end koncentrationen af OH-ioner-1. Derfor er pH større end pOH i et surt medium, men dens sum er altid lig med 14.
Også jo større er koncentrationen af H-ioner3O+, jo højere pH-værdi. Ved stuetemperatur (25°C), pH < 7 og pOH > 7.

- Grundlæggende betyder:
I basismediet er koncentrationen af OH-ioner- er større end H-ioners3O+.
Hvis vi tilføjer en base til vand, betyder det, at vi tilføjer OH-ioner.- og, som forklaret i det foregående punkt, ved Le Chateliers princip, ligevægten i reaktionen af selvionisering af vand vil bevæge sig i den modsatte retning, hvor overskydende ioner reagerer med H ioner3O+, mindske din koncentration og gøre opløsningen basisk.
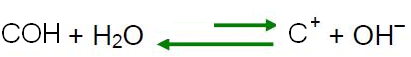
I så fald vil pOH være større end pH. Ved stuetemperatur (25°C), pH > 7 og pOH < 7.

Kort:
Af Jennifer Fogaça
Uddannet i kemi
