Mekanismen er en simulering af den måde, reaktionen behandles på, den beskriver de trin, som reaktanterne gennemgår for at nå det endelige produkt.
Mekanismer blev foreslået baseret på eksperimenter, da det ikke er muligt at visualisere trin for trin af en reaktion, og er meget nyttige i Organisk kemi, da organiske forbindelser reagerer med hinanden på forskellige måder: bryde bindinger, danner forbindelser mellemmænd.
Der er faktorer, der interfererer med reaktionens slutprodukt, såsom for eksempel opløsningsmidlets beskaffenhed, polaritet af bindinger, udveksling af elektroner osv. Derfor er en bestemt mekanisme ikke altid den eneste måde at danne produktet på, de kan forekomme på forskellige måder, f.eks. ionisk eller via frie radikaler.
1. ionisk mekanisme: proces, der starter gennem heterolytisk brud af en kovalent binding og dannelse af ioner (carbocation og carbanion).
Spor alkenhalogeneringsmekanismen.
Vi kan opdele mekanismen i faser:
1. etape: Heterolytisk afbrydelse af den kovalente binding (Cl - Cl): dannelse af carbocation og anion (Cl-).
2. etape: Kloridanion (Cl-) angreb på karbokation.
3. etape: Dannelse af produkt 1,2 - dichlorpropan.
Som det kan ses, sker halogeneringen af alkener gennem en ionisk mekanisme.
Bemærk: Som navnet antyder, udføres halogenering ved at tilføje et halogen (klor) til molekylet.
2. Mekanisme via frie radikaler: det homolytiske brud af en kovalent binding danner frie radikaler (meget ustabile og reaktive), lad os se på et eksempel:
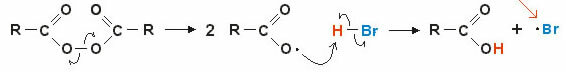
Reaktionen starter med brydning af peroxidbindingen og dannelse af frie radikaler. I det mellemliggende trin sker radikalangrebet på det polariserede brint af (H — Br) og deraf følgende dannelse af det nye frie radikal • br (meget ustabil og reaktiv).
Af Líria Alves
Uddannet i kemi
Brasiliens skolehold
Se mere!
Radikaler i organisk kemi
Organisk kemi - Kemi - Brasilien skole
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/mecanismos-reacoes-organicas.htm

