Bufferløsning det er en homogen blanding, der ikke ændrer pH eller pOH, når der tilsættes små mængder stærk syre eller stærk base til denne blanding. Blandingen ændrer dog ikke kun pH eller pOH, hvis den præsenterer en af de to sammensætninger nedenfor:
Prop syre (pH mindre end 7):
Den har svag syre blandet med en salt opløselig, der har den samme anion, såsom cyanbrinte (HCN) og kaliumcyanid (KCN), som har den samme cyanidanion (CN).
Grundlæggende buffer (pH større end 7):
Grundlag svagt blandet med et salt, der har den samme kation, såsom zinkhydroxid [Zn(OH)2] og zinkchlorid (ZnCl2), som har den samme zinkkation (Zn+2).
Det er vigtigt, for at forstå, hvilken indflydelse en bufferopløsning har på modtagelse af en stærk syre eller base, at huske, hvornår syrer og baser anses for stærke:
→ Rangordning af baser med hensyn til styrke
stærk: baser med kemiske grundstoffer fra familierne IA (alkalimetaller) og IIA (jordalkalimetaller), med undtagelse af magnesium;
svag: baser, der har grundstoffet magnesium og et andet, så længe det ikke tilhører IA- og IIA-familierne.
→ Klassificering af syre for styrke
a) For hydrater (iltfrie syrer):
stærk: kun HCI, HBr og HI;
moderate: Kun HF;
svag: enhver anden hydroxid.
b) For oxysyrer (syrer med ilt):
stærk: når subtraktionen af antallet af oxygener med antallet af hydrogener er lig med eller større end 2;
moderate: når subtraktionen af antallet af oxygener med antallet af hydrogener er lig med 1;
svag: når subtraktionen af antallet af oxygener med antallet af hydrogener er lig med eller mindre end 0.
Indflydelse af at tilføje en stærk base til en buffer
For at forklare, lad os bruge bufferopløsning dannet af zinkhydroxid [Zn(OH)2] og det opløselige salt af zinkchlorid (ZnCl2), som vil modtage en lille mængde stærk natriumhydroxid (NaOH) base. Se saldierne i denne bufferløsning:
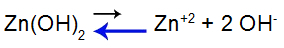
Base dissociation ligevægtsligning
Balancen skifter til venstre, fordi basen er svag.
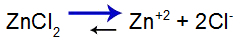
Salt dissociation ligevægtsligning
Balancen skifter til højre, fordi salt er opløseligt.
Den stærke base har følgende balance:
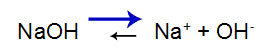
Base dissociation ligevægtsligning
Balancen skifter til højre, fordi basen er stærk.
Den tilsatte stærke base frigiver hydroxidanionen (OH) til vand-), som har en høj affinitet for zinkkationer (Zn+2) fra saltet i anden ligevægt. Forbindelsen mellem hydroxid og zink danner zinkhydroxid:
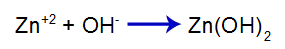
basedannelsesligning
Så OH- af base reducerer mængden af zink i den anden ligevægt og øger mængden af base [Zn(OH)2], hvilket får det til at dissociere yderligere og frigive Zn-kationer+2 i den første ligevægt. Da vi ikke kommer til at have en ændring i mængden af hydroxid i mediet, ændres pH-værdien derfor ikke.
Indflydelse af tilsætning af en stærk syre til en buffer
For at forklare, lad os bruge bufferen dannet af zinkhydroxid [Zn(OH)2] og af det opløselige salt af zinkchlorid (ZnCl2), som vil modtage en lille mængde hydrogeniodsyre (HI), som er stærk. Se saldierne i loftet:
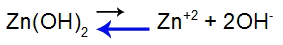
Base dissociation ligevægtsligning
Balancen flyttet til venstre, fordi basen er svag.
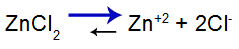
saltbalanceligning
Balancen flyttet til højre, fordi salt er opløseligt.
Stærk syre har følgende balance:
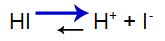
Syrebalanceligning
Balancen flyttet til højre, fordi syren er stærk.
Den tilsatte syre producerer hydroniumkationen i vand (H+), som har en høj affinitet for hydroxidioner (OH-) fra basen. Forbindelsen mellem hydronium og hydroxid danner et vandmolekyle:
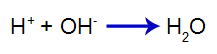
vanddannelsesligning
Så H+ syre reducerer mængden af hydroxider i den første ligevægt, hvilket øger basedissociationen. Da vi ikke kommer til at have en ændring i mængden af hydroxid i mediet, ændres pH-værdien derfor ikke.
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-solucao-tampao.htm

