Kp er det akronym, der bruges til at bestemme konstant for en ligevægt med hensyn til deltryk. Denne konstant arbejder for eksempel med værdierne af de gasformige deltagere i en ligevægt i atm-enheden.

Ligning, der repræsenterer en kemisk reaktion med gasformige komponenter
I denne ligning er alle deltagere gasformige, så når en deltagende gas har en partialtryk i blandingen, er det repræsenteret af forkortelsen pX.
Ved opstilling af den kemiske ligevægtsligning (koncentrationsmæssigt) skal produkterne placeres i tælleren, og reaktanterne placeres i nævneren:
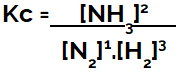
Kc udtryk for ammoniakdannelsesligevægt
udtryk for ligevægtskonstant i form af tryk (Kp) følger mønsteret af Kcdet vil sige, at reagensernes partialtryk er placeret i nævneren og produkternes partialtryk i tælleren:
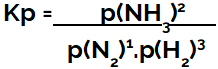
Kp-ekspression af ammoniakdannelsesligevægt
Observation: Hvis reaktionsligningen for kemisk balance ikke præsentere nogen gasformig deltager, vil den ikke automatisk præsentere Kp.
Eksempel: (PUC-MG) Til reaktionen: 2 CO(g) + O
2(g)? 2 CO2(g), partialtrykket af CO(g) Det er2(g) ved ligevægt er de henholdsvis 0,2 atm og 0,4 atm. Det samlede systemtryk er 1,4 atm. Værdien af Kp for reaktionen er:a) 56,2
b) 40,0
c) 35,6
d) 28,4
e) 25,6
De data, som øvelsen giver, er:
Kuliltepartialtryk (pCO) = 0,2 atm;
Partialtryk af kulilte (pO2) = 0,4 atm;
Totaltryk = 1,4 atm;
For at bestemme Kp af dette system skal vi udføre følgende trin:
1. trin: Bestem partialtrykket for kulilte (pCO2).
Til dette skal du blot huske, at det samlede tryk (pt) er summen af alle partialtryk:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 atm
2. trin: Bestem øvelsens Kp.
Til dette skal du blot bruge værdierne i udtrykket af ligevægtskonstanten Kp:
Kp = (pCO2)2
(pCO)2.(støv2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm

