Sulfater er ioniske forbindelser, der indeholder anionen SO42-, som kaldes sulfatanionen.
Svovl er et element i 16- eller VI-A-familien, hvilket betyder, at den har 6 elektroner i sin valensskal. I henhold til oktetreglen ville det være nødvendigt at modtage 2 flere elektroner for at have 8 elektroner i den sidste elektronskal og dermed være stabil. Men svovl gennemgår oktetudvidelse, da det er et element, der ligger i den tredje periode i tabellen Periodisk, er relativt stor, hvilket gør det muligt at rumme mere end otte elektroner til sin rundt om.
Som det kan ses nedenfor, udvides svovlets valensniveau således til at rumme i alt 12 elektroner. Men to iltatomer er stadig ikke stabile, hver med syv elektroner i valensskallen, og har således brug for at modtage endnu en elektron for at stabilisere sig. Af denne grund er ladningen af hvert af disse to atomer -1, hvilket resulterer i en samlet ladning for anionen på -2:
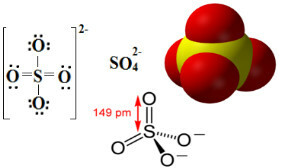
Sulfatanionen kan komme fra svovlsyre (H.2KUN4 (aq)) vist nedenfor:
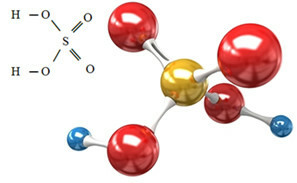
Svovlsyre reagerer med en eller anden base i en neutraliserende reaktion og danner et uorganisk salt, som er vores sulfat, og også vand:
Generisk reaktion: Svovlsyre + base → Salt (sulfat) + vand
H2KUN4 + 2 ÇÅh →Ç2KUN4+ 2 H2O
Se et eksempel nedenfor, hvor der dannes kaliumsulfat:
H2KUN4 + 2 KOH →K2KUN4+ 2 H2O
Bemærk, at nomenklaturen for et sulfat sker simpelthen ved reglen: sulfat + navnet på det element, der er knyttet til det. Derudover fremstilles formlerne for sulfater ved at udveksle ladningen af hver ion for elementindekset med indekset "1", der ikke behøver at skrives:
Eksempler:
På+1 KUN42- → På2KUN4→ natriumsulfat
mg+2 KUN42- → MgSO44→ magnesiumsulfat
Her+2 KUN42- → Sag4→ calciumsulfat
Ba+2 KUN42- → BASO4→ bariumsulfat
Al+3 KUN42- → Al2(KUN4)3→ aluminiumsulfat
Salte indeholdende sulfationen er normalt opløselige i vand, undtagelserne er fire: calciumsulfat (CaSO4), strontiumsulfat (SrSO4), bariumsulfat (BaSO4) og blysulfat (PbSO4). Dette skyldes, at der er en høj bindingsenergi mellem disse kationer (Ca2+, sir2+, Ba2+ og Pb2+) og sulfatet, da de alle har en ladning +2, og sulfatanionen har en ladning -2. Således bliver det vanskeligere at afbryde forbindelsen.
Sulfater findes i form af krystallinske gitter på grund af den tiltrækning, som modsatte ladninger udøver på hinanden, som vist nedenfor i tilfælde af kobbersulfat (CuSO4):

Sulfater findes i naturen hovedsageligt i form af mineraler. Se nogle eksempler:
baryt → bariumsulfat;
Gips → calciumsulfat;
Celestite → strontiumsulfat;
anglesiOkay → bly sulfat;
Glauberit → dobbelt calcium og natriumsulfat: CaNa2(KUN4)2;
Kaliumalun (kalinit) → hydreret dobbeltkaliumaluminiumsulfat: KAl (SO42,11 H2O
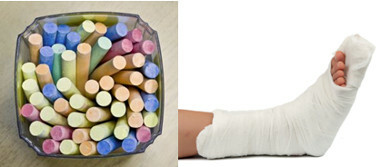
Blandt de vigtigste sulfater i hverdagen har vi calciumsulfat, som i vandfri form (uden vand) bruges til fremstilling af skolekridt. Når det er i dihydratform, (CaSO4 .2 timer2O), det er kendt som gips og er mere rigeligt. Efter opvarmning danner det calciumsulfathemihydrat (CaSO4. ½H2O), som er gips, der bruges i ortopædi, tandforme, civil konstruktion og maling.
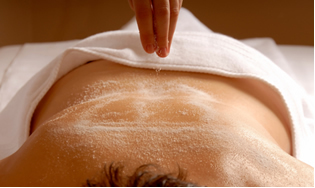
Et andet vigtigt salt er smagnesiumsulfat (MgSO44), kendt som sbitter al eller Epsom salt, der har afføringsmiddel og bruges til massage og afslappende bade.
Af Jennifer Fogaça
Uddannet i kemi
