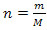Termodynamik er et fysikområde, der studerer energioverførsler. Det søger at forstå forholdet mellem varme, energi og arbejde, analysere mængderne af varme, der udveksles, og det arbejde, der udføres i en fysisk proces.
Termodynamisk videnskab blev oprindeligt udviklet af forskere, der ledte efter en måde at forbedre maskiner på i den industrielle revolution, hvilket forbedrede deres effektivitet.
Denne viden anvendes i øjeblikket i forskellige situationer i vores daglige liv. For eksempel: termiske maskiner og køleskabe, bilmotorer og processer til transformation af mineraler og olieprodukter.
Lov om termodynamik
De grundlæggende love inden for termodynamik styrer, hvordan varme bliver til arbejde og omvendt.
Første lov om termodynamik
DET Første lov om termodynamik vedrører princippet om energibesparelse. Dette betyder, at energi i et system ikke kan ødelægges eller skabes, kun transformeres.
Formlen, der repræsenterer termodynamikens første lov, er som følger:

Mængden af varme, arbejde og variation af intern energi har som standard måleenhed Joule (J).
Et praktisk eksempel på energibesparelse er, når en person bruger en pumpe til at puste et oppusteligt objekt op, bruger han kraft til at pumpe luft ind i objektet. Dette betyder, at kinetisk energi får stemplet til at gå ned. En del af denne energi omdannes imidlertid til varme, som går tabt for miljøet.
DET Hess 'lov er et særligt tilfælde af princippet om energibesparelse. Lær mere!
Anden lov om termodynamik
På varmeoverførsler de forekommer altid fra den varmeste krop til den koldeste krop, det sker spontant, men ikke omvendt. Det vil sige, at termiske energioverførselsprocesser er irreversible.
På denne måde af Anden lov om termodynamik, er det ikke muligt for varme at blive fuldstændig konverteret til en anden form for energi. Af denne grund betragtes varme som en forringet form for energi.

Den fysiske størrelse relateret til termodynamikens anden lov er entropi, hvilket svarer til graden af forstyrrelse i et system.
Læs også:
- Carnot cyklus
- Varmeudvidelse
Nul lov om termodynamik
DET Nul lov om termodynamik beskæftiger sig med betingelserne for at opnå termisk balance. Blandt disse betingelser kan vi nævne indflydelsen af materialer, der gør varmeledningsevnen højere eller lavere.
I henhold til denne lov,
- hvis et legeme A er i termisk ligevægt i kontakt med et legeme B og
- hvis dette legeme A er i termisk ligevægt i kontakt med et legeme C, så
- B er i termisk ligevægt i kontakt med C.
Når to kroppe med forskellige temperaturer bringes i kontakt, overfører den, der er varmere, varmen til den, der er køligere. Dette får temperaturen til at udjævne, når den når termisk balance.
Det kaldes nul-loven, fordi dets forståelse viste sig nødvendigt for de to første love, der allerede eksisterede, den første og anden lov om termodynamik.
Tredje lov om termodynamik
DET Tredje lov om termodynamik det fremstår som et forsøg på at etablere et absolut referencepunkt, der bestemmer entropi. Entropi er faktisk grundlaget for den anden lov om termodynamik.
Walther Nernst, fysikeren, der foreslog det, konkluderede, at det ikke var muligt for et rent stof med en temperatur på nul at have entropi med en omtrentlig værdi på nul.
Af denne grund er det en kontroversiel lov, der af mange fysikere betragtes som en regel og ikke en lov.
termodynamiske systemer
I et termodynamisk system kan der være en eller flere kroppe, der er beslægtede. Miljøet, der omgiver det og universet, repræsenterer miljøet uden for systemet. Systemet kan defineres som: åbent, lukket eller isoleret.
 termodynamiske systemer
termodynamiske systemer
Når systemet åbnes, sker der en overførsel af masse og energi mellem systemet og det eksterne miljø. I det lukkede system er der kun energioverførsel (varme), og når det er isoleret, er der ingen udveksling.
opførsel af gasser
Den mikroskopiske opførsel af gasser beskrives og fortolkes lettere end i andre fysiske tilstande (flydende og fast). Derfor bruges gasser mest i disse undersøgelser.
I termodynamiske undersøgelser anvendes ideelle eller perfekte gasser. Det er en model, hvor partikler bevæger sig kaotisk og kun interagerer i kollisioner. Desuden anses det for, at disse kollisioner mellem partiklerne og mellem dem og beholdervæggene er elastiske og varer i meget kort tid.
I et lukket system forudsætter den ideelle gas en opførsel, der involverer følgende fysiske størrelser: tryk, volumen og temperatur. Disse variabler definerer en gass termodynamiske tilstand.
 Opførsel af gasser i henhold til gaslove
Opførsel af gasser i henhold til gaslove
Tryk (p) frembringes ved bevægelse af gaspartikler inde i beholderen. Rummet optaget af gassen inde i beholderen er volumen (v). Og temperaturen (t) er relateret til den gennemsnitlige kinetiske energi af de bevægelige gaspartikler.
Læs også Gaslov og Undersøgelse af gasser.
intern energi
Et systems interne energi er en fysisk størrelse, der hjælper med at måle, hvordan de transformationer, en gas gennemgår, finder sted. Denne størrelse er relateret til variationen i partiklernes temperatur og kinetiske energi.
En ideel gas, der består af kun en type atom, har intern energi, der er direkte proportional med temperaturen på gassen. Dette er repræsenteret af følgende formel:

Løst øvelser om termodynamik
Spørgsmål 1
En cylinder med et bevægeligt stempel indeholder en gas ved et tryk på 4.0.104N / m2. Når der tilføres 6 kJ varme til systemet ved konstant tryk, udvides gasvolumenet med 1.0.10-1m3. Bestem det udførte arbejde og ændringen i intern energi i denne situation.
Korrekt svar: det udførte arbejde er 4000 J, og den interne energiforandring er 2000 J.
Data:
P = 4,0.104 N / m2
Q = 6KJ eller 6000J
AV = 1,0.10-1 m3
T =? ΔU =?
1. trin: Beregn arbejdet med problemdataene.
T = P. AV
T = 4.0.104. 1,0.10-1
T = 4000 J
2. trin: Beregn variationen af den interne energi med de nye data.
Q = T + ΔU
ΔU = Q - T
ΔU = 6000 - 4000
ΔU = 2000J
Derfor er det udførte arbejde 4000 J, og den interne energiforandring er 2000 J.
spørgsmål 2
(Tilpasset fra ENEM 2011) En motor kan kun udføre arbejde, hvis den modtager en mængde energi fra et andet system. I dette tilfælde frigives den energi, der er lagret i brændstoffet, delvis under forbrændingen, så apparatet kan fungere. Når motoren kører, kan noget af den energi, der er omdannet eller transformeret i forbrændingen, ikke bruges til at udføre arbejde. Dette betyder, at der er energilækage i en anden form.
Ifølge teksten skyldes energitransformationer, der opstår under motordrift:
a) varmeafgivelse inde i motoren er umulig.
b) arbejde udført af motoren er ukontrollerbart.
c) fuldstændig omdannelse af varme til arbejde er umulig.
d) transformation af termisk energi til kinetik er umulig.
e) det potentielle energiforbrug af brændstoffet er ukontrollerbart.
Korrekt alternativ: c) fuldstændig omdannelse af varme til arbejde er umulig.
Som tidligere set kan varme ikke omdannes fuldt ud til arbejde. Under motordriften går en del af den termiske energi tabt og overføres til det eksterne miljø.
Se også: Øvelser på termodynamik