Et halogenid er en organisk forbindelse, der har mindst et halogenatom. - det vil sige kemiske grundstoffer fra familie 17 eller VII i det periodiske system (F, Cl, Br, I eller generisk: X) - bundet til en gruppe afledt af et carbonhydrid.
RX (hvor X = F, Cl, Br eller I)
Nogle halogenider er vist nedenfor:

Jod er den mest reaktive af alle, og fluor mindst, fordi bindingsenergien mellem halogen og kulstof stiger fra jodretningen til fluorretningen.
Et andet punkt er, at reaktivitet også øges i denne forstand:

Denne reaktivitet forekommer således med større lethed i tertiære kulstofhalogenider på grund af karakteren erhvervet af kulstoffet bundet til det organiske halogenid:

Således tiltrækkes substituentgruppen, såsom OH, der vil danne alkoholen, stærkere til det tertiære carbon, som har en positiv karakter (1+), og substitutionen er lettere.
Halider kan gennemgå reaktioner, der tillader os at opnå praktisk talt alle andre organiske funktioner (alkohol, ether, alkyn, cyanid eller nitril, amin, blandt andre). Dette er imidlertid umuligt i praksis, da halogenider er meget dyre forbindelser.
For at fremstille en alkohol omsættes f.eks. Et halogenid med en stærk base, såsom natriumhydroxid, i et vandigt medium. Lad os se et eksempel nedenfor, hvor der fra den alkaliske hydrolyse af ethylchlorid (chlorethan) dannes ethanol:
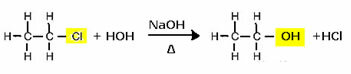
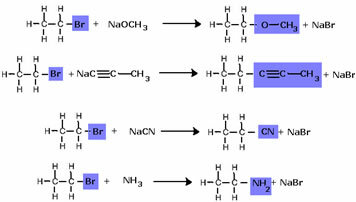
Bemærk, at halogenidgruppen blev erstattet af OH, den alkoholfunktionelle gruppe. Den samme ordning følges til dannelse af andre grupper, idet der kun skelnes mellem reagenset:
Af Jennifer Fogaça
Uddannet i kemi
Brazil School Team
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/reacoes-substituicao-haletos-organicos.htm

