Eksperimenter er en praktisk måde at lære og teste din viden om de begreber, der studeres i kemi.
Udnyt disse kemiske eksperimenter, som kan gøres derhjemme (under voksenovervågning) eller arbejdes med i undervisningen sammen med læreren for at supplere dine studier.
Første oplevelse - afsløring af farverne
Involverede begreber: kromatografi og adskillelse af blandinger
Materialer
- penne (markerede markører) i forskellige farver
- alkohol
- kaffefilterpapir
- kop (glas for at lette overvågningen af eksperimentet)
Hvordan laver man
- Brug saks og skær strimler med filterpapir. Lav et rektangel for hver brugt pen.
- Nu, i en afstand på ca. 2 cm fra bunden, tegner du en cirkel med din valgte farvepen og maler hele indersiden.
- Lim kanten af papiret længst væk fra den trukkede marmor på en støtte. Til dette kan du bruge et bånd og vedhæfte det til en blyant.
- Tilsæt alkohol i koppen, ikke for meget, da det bare skal røre ved enden af papiret nær penmærket.
- Læg papiret i koppen, så det er lodret. Blyanten, der understøtter den, skal hvile på kanterne.
- Vent mellem 10 og 15 minutter til alkoholen stiger gennem filterpapiret. Fjern derefter papirerne og lad dem tørre.
Resultat
Når alkohol passerer gennem penmærket, interagerer det med farvekomponenterne og driver dem på tværs af papiret. De forskellige pigmenter adskilles således ved kontakt med alkohol.
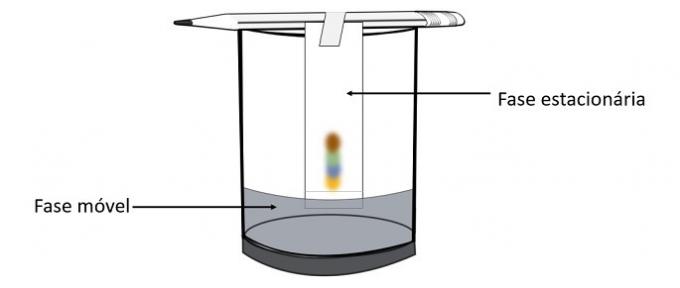
Gennem dette eksperiment er det muligt at vide, hvilke farver der blev blandet for at skabe pennens farve.
Forklaring
Kromatografi er en type proces til adskillelse af blandinger. Filterpapir er den stationære fase, og alkohol er den mobile fase, der trækker komponenterne i blandingen, når den passerer gennem den stationære fase. Jo større interaktion med alkoholen er, desto hurtigere bevæger pigmentet sig med opløsningsmidlets passage.
Materialets bestanddele, da de har forskellige egenskaber, vil interagere med den mobile fase på forskellige måder, hvilket kan bemærkes af de forskellige trækperioder i den stationære fase.
Lær mere om kromatografi.
2. oplevelse - konservering af mad
Involverede begreber: organiske forbindelser og kemiske reaktioner
Materialer
- æble, banan eller pære
- citron eller appelsinjuice
- C-vitamin tablet
Hvordan laver man
- Vælg en af de tre frugter og skær den i 3 lige store dele.
- Det første stykke vil tjene som en sammenligning med de andre. Så tilføj ikke noget til det, bare lad det udsættes for luft.
- Drypp indholdet af en citron eller en appelsin i et af stykkerne. Spred, så hele indersiden af frugten er dækket med juice.
- I den sidste del skal du sprede C-vitamin, det kan være en knust tablet over hele frugtmassen.
- Se hvad der sker, og sammenlign resultaterne.
Resultat
Papirmassen, der er udsat for luft, skal hurtigt blive mørkere. Citron- eller appelsinsaft og C-vitamin, et kemikalie kaldet ascorbinsyre, skal bremse frugten.

Forklaring
Når vi skærer en frugt, beskadiges dens celler, der frigiver enzymer som polyphenoloxidase, som i kontakt med luften oxiderer de phenolforbindelser, der findes i maden, og forårsager en enzymatisk bruning.
For at forhindre virkningen af ilt anvendes konserveringsmidler, såsom ascorbinsyre, fordi de fortrinsvis oxideres i stedet for phenolforbindelser. Ud over C-vitamin-tabletten er ascorbinsyre også til stede i naturlige kilder, såsom citrus, citron og appelsin, foreslået i eksperimentet.
Lær mere om oxidation.
3. oplevelse - hvem fryser hurtigere?
Involverede begreber: kolligative egenskaber og kryoskopi
Materialer
- to rør (bruges til festfavør)
- glasskål
- bordsalt
- filtreret vand
- is
- termometer
Hvordan laver man
- Tilsæt den samme mængde filtreret vand til begge rør. For eksempel 5 ml i hvert rør.
- Tilsæt bordsaltet til et af rørene, og læg et identifikationsbånd for at skelne ud, hvilket salt der er.
- Fyld glasbeholderen med knust is og tilsæt salt.
- Placer de to rør samtidigt inde i isen og se hvad der sker.
- Registrer frysetemperaturen for hver situation.
Resultat
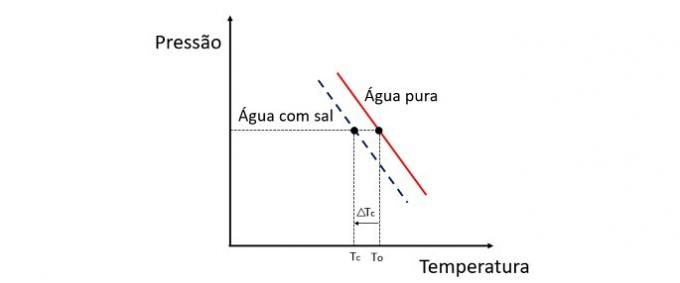
Tilføjelse af et opløst stof til vand sænker frysetemperaturen. Derfor har almindeligt vand en tendens til at fryse meget hurtigere end en salt- og vandopløsning, når de udsættes for de samme forhold.
Forklaring
Kryoskopi er en kolligativ egenskab, der studerer variationen i temperaturen på et opløsningsmiddel, når forskellige mængder opløst stof er opløst i det.
Sænkning af frysetemperaturen for vand er forårsaget af en ikke-flygtig opløsningsmiddel, og dette fænomen har mange praktiske anvendelser. Derfor, jo større koncentration af opløst stof i opløsningen påvirker den kryoskopiske effekt.
Hvis f.eks. Vand fryser ved 0 ° C, og vi tilsætter salt til det, vil faseskiftetemperaturen være negativ, dvs. meget lavere.
Derfor fryser havvand ikke steder, hvis temperatur er under 0 ° C. Salt opløst i vand har en tendens til yderligere at sænke frysetemperaturen. På steder, hvor der er sne, er det også almindeligt at smide salt på vejene for at smelte isen og undgå ulykker.
Lær mere om kolligative egenskaber.
4. eksperiment - nedbrydning af hydrogenperoxid
involverede begreber: kemisk reaktion og katalysator
Materialer
- En halv rå kartoffel og en halv kogt
- Et stykke rå lever og et andet kogt stykke
- Brintoverilte
- 2 retter
Hvordan laver man
- I hver skål tilsættes mad, kartofler sammen og lever sammen.
- I hvert af de fire materialer tilsættes 3 dråber hydrogenperoxid.
- Se hvad der sker, og sammenlign resultaterne.
Resultat
Hydrogenperoxid, en hydrogenperoxidopløsning, når den kommer i kontakt med rå fødevarer, begynder at sprede næsten øjeblikkeligt.
Dette eksperiment kan også udføres ved at tilføje et stykke mad til en beholder med hydrogenperoxid for at gøre reaktionen mere mærkbar.
Forklaring
Brusningen fra hydrogenperoxid, når den kommer i kontakt med rå fødevarer, kendetegner forekomst af en kemisk reaktion, som er nedbrydningen af hydrogenperoxid og frigivelse af gassen ilt.
Nedbrydningen af hydrogenperoxid sker gennem virkningen af katalaseenzymet, der findes i peroxisomes organelle, der findes i dyre- og planteceller.
Det er vigtigt at bemærke, at nedbrydningen af hydrogenperoxid sker spontant i nærværelse af sollys, men i en meget langsom reaktion. Katalase fungerer imidlertid som en katalysator, hvilket øger hastigheden af den kemiske reaktion.
Hydrogenperoxid kan være et giftigt stof for celler. Derfor nedbryder katalase forbindelsen og producerer vand og ilt, to stoffer der ikke skader kroppen.
Når mad er kogt, gennemgår dets komponenter ændringer. Modifikationerne forårsaget af madlavning kompromitterer også virkningen af katalase ved denaturering af proteinet.
Den samme handling, vi ser med mad, er hvad der sker, når vi lægger hydrogenperoxid på et sår. Catalase virker, og der er dannelse af bobler, som består i frigivelse af ilt.
Lær mere om kemiske reaktioner.
Bibliografiske referencer
SAINT, W. L. P.; MOL, G. S. (Koordinater). Citizen Chemistry. 1. red. São Paulo: Ny generation, 2011. v. 1, 2, 3.
BRAZILIANSK KEMISK SAMFUND (org.) 2010. Kemi i nærheden af dig: billige eksperimenter til K-12 klasseværelset. 1. red. Sao Paulo.