Smeltepunktet og kogepunktet repræsenterer den temperatur, ved hvilken et stof ændrer tilstand ved et givet tryk.
I tilfælde af smeltepunktet skifter stoffet fra fast tilstand til flydende tilstand. Kogepunktet refererer til ændringen fra den flydende tilstand til den gasformige tilstand.
For eksempel begynder is at blive til vand i flydende form, når dens temperatur er lig med 0 ° C. Derfor er smeltepunktet for vand 0 ° C (under et tryk på 1 atmosfære).
For at skifte fra væske til damp skal vand nå en temperatur på 100 ° C. Vandets kogepunkt er således 100 ° C (under et tryk på 1 atmosfære).

Fusionspunkt
Når et stof i fast tilstand modtager varme, er der en stigning i graden af omrøring af dets molekyler. Derfor stiger temperaturen også.
Når en bestemt temperatur (smeltepunkt) er nået, er molekylernes omrøring sådan, at de bryder de indre bindinger mellem atomer og molekyler.
På dette tidspunkt begynder stoffet at ændre sin tilstand og vil gå i flydende tilstand, hvis det fortsætter med at modtage varme.
Under Fusion dens temperatur forbliver konstant, da den modtagne varme udelukkende bruges til tilstandsændring.

Varmen pr. Masseenhed, der kræves for at ændre faser, kaldes latent varme af fusion (Lf) og er et kendetegn ved stoffet.
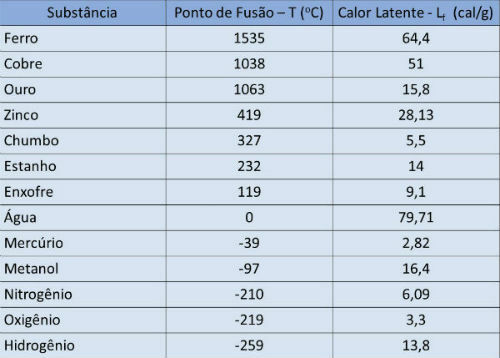
Smeltepunkt og latent varmebord
I nedenstående tabel angiver vi smeltepunktstemperaturen og den latente varme fra nogle stoffer til atmosfærisk tryk.
Kogepunkt
DET kogende det er kendetegnet ved hurtig passage fra en væske til en gasformig tilstand med dannelse af dampe (bobler) inde i væsken.
Som ved fusion er der en temperatur (kogepunkt), hvor et givet stof skifter fra en væske til en gasformig tilstand.
For at dette kan ske, skal stoffet modtage varme. Under hele faseændringen forbliver temperaturen konstant.
den latente varme af fordampning (Lv) er den mængde varme pr. masseenhed, der kræves for at et stof skifter fase.
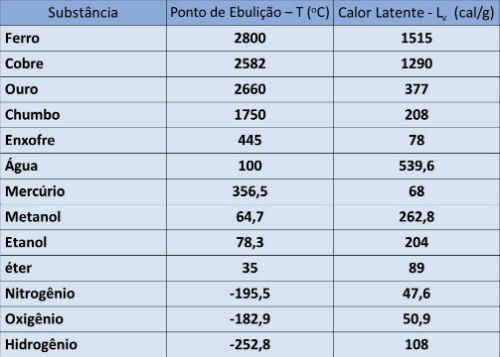
Kogepunkt og latent varmebord
I nedenstående tabel angiver vi kogepunktstemperaturen og den latente fordampningsvarme for nogle stoffer ved atmosfærisk tryk.
Trykinterferens
Smeltepunktets og kogepunktets temperatur afhænger af stoffets tryk.
Generelt øges stoffer i volumen, når de gennemgår fusion. Denne kendsgerning betyder, at jo højere tryk, desto højere temperatur for stoffet at ændre sin fase.
Undtagelsen forekommer med nogle stoffer, herunder vand, der nedsætter volumenet, når det smeltes. I dette tilfælde nedsætter højere tryk smeltepunktet.

Et fald i tryk får kogepunktet for et givet stof til at være lavere, hvilket betyder, at stoffet koger ved en lavere temperatur.
For eksempel koger vand over havoverfladen vand ved temperaturer under 100 ° C. Som et resultat tager det meget længere tid at lave mad på disse steder end steder på havets overflade.
Læs også:
- Fysiske tilstandsændringer
- Termometriske skalaer
- Termometriske skalaer - Øvelser
- Fysiske vandtilstande
- Fasediagram
- Størkning
- Kondensation
- Colligative egenskaber
- Periodiske egenskaber
- Fordampning
- Øvelser på det periodiske system

