Opløsning og opløsningsmiddel er de to komponenter i en homogen blanding kaldet en kemisk opløsning.
- Opløs: er det stof, der er dispergeret i opløsningsmidlet. Det svarer til det stof, der vil blive opløst og præsenterer sig generelt i en mindre mængde i opløsningen.
- Opløsningsmiddel: er det stof, hvor det opløste stof opløses i et nyt produkt. Det præsenterer sig i større mængde i løsningen.
Opløsning mellem det opløste stof (dispergeret) og opløsningsmidlet (dispergeringsmiddel) sker gennem interaktioner mellem deres molekyler.
Forskellen mellem disse to komponenter i en opløsning er, at det opløste stof er det stof, der vil opløses, og opløsningsmidlet er det stof, der påvirker opløsning.
Det mest kendte opløsningsmiddel er vand, der betragtes som universal opløsningsmiddel. Det er fordi det har evnen til at opløse en stor mængde stoffer.
Eksempler på opløsningsmidler og opløsningsmidler
Se nogle eksempler på kemiske opløsninger, og opdag opløste stoffer og opløsningsmidler for hver enkelt af dem:
Vand og salt
- Opløsning: Bordsalt - Natriumchlorid (NaCl)
- Opløsningsmiddel: Vand
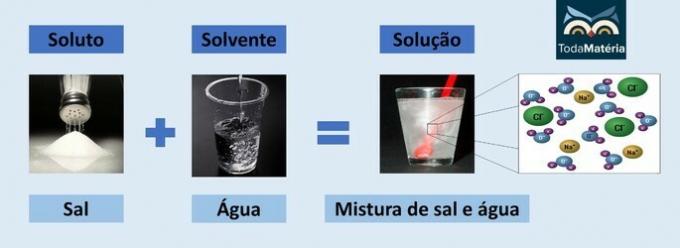
Da det er en ionforbindelse, dissocieres natriumchloridet i opløsningen og danner ioner, som igen bliver solvatiseret af molekyler af Vand.
Den positive pol af vand (H+) interagerer med anionen af salt (Cl-) og den negative vandpol (O2-) interagerer med kationen (Na+).
Dette er en type elektrolytisk opløsning, da de ioniske arter i opløsning er i stand til at lede en elektrisk strøm.
vand og sukker
- Opløsning: Sukker - saccharose (C12H22O11)
- Opløsningsmiddel: Vand

Sukker er en kovalent forbindelse, og når det opløses i vand molekyler de spredes, men ændrer ikke deres identitet.
Denne vandige opløsning er klassificeret som ikke-elektrolytisk, da det opløste stof, der er dispergeret i opløsningen, er neutralt og derfor ikke reagerer med vand.
Eddike
- Opløseligt: Eddikesyre (CH3COOH)
- Opløsningsmiddel: Vand

Eddike er en opløsning, der indeholder mindst 4% eddikesyre, a carboxylsyre som er polar, interagerer med vand, også polar, gennem hydrogenbindinger.
En vigtig regel for opløselighed er, at lignende opløses som. Polære forbindelser opløses i polære opløsningsmidler, mens ikke-polære stoffer opløses i ikke-polære opløsningsmidler.
Andre løsninger
Ud over flydende opløsninger findes der også gasformige og faste opløsninger.
Luften, vi indånder, er et eksempel på en gasformig opløsning, hvis gasser i større mængde er nitrogen (78%) og ilt (21%).
På metallegeringer de er solide løsninger. For eksempel er messing (zink og kobber) en blanding, der bruges til at fremstille musikinstrumenter.
Vil du få mere viden? Så læs disse andre tekster:
- Kemiske løsninger
- intermolekylære kræfter
- Homogene og heterogene blandinger
Hvad er opløselighedskoefficienten?
Opløselighedskoefficienten er grænsen for opløst stof tilsat opløsningsmidlet ved en given temperatur for at danne en mættet opløsning.
O opløselighedskoefficient varierer alt efter forholdene og kan stige eller falde i henhold til temperaturændringer og det pågældende opløste stof.
Der er en grænse for, hvor opløsningsmidlet kan udføre opløsning.
Eksempel: Hvis du lægger sukker i et glas vand, i første øjeblik, vil du bemærke, at sukkeret forsvinder i vandet.
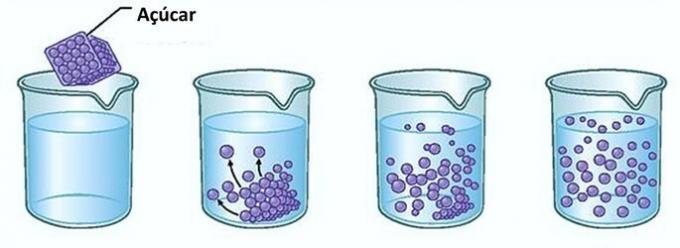
Men hvis du fortsætter med at tilsætte sukker, vil du opdage, at det på et tidspunkt begynder at ophobes i bunden af glasset.
Dette skyldes, at vandet, som er opløsningsmidlet, har nået sin grænse på opløselighed og den maksimale koncentrationsmængde. Opløsningsmidlet, der forbliver i bunden af beholderen og ikke opløses, kaldes baggrund krop.
Overskydende sukker i bunden af glasset opløses ikke og påvirker ikke koncentrationen af opløsningen. Desuden vil sukkeret, der er afsat i bunden af glasset, ikke gøre vandet sødere.
Klassificering af løsninger
Opløsninger kan klassificeres efter mængden af opløst opløst stof. Således kan de være af tre typer: mættet, umættet og overmættet.
- mættet opløsning: Opløsningen har nået grænsen for opløselighedskoefficienten, dvs. der er en maksimal mængde opløst stof opløst i opløsningsmidlet ved en bestemt temperatur.
- umættet opløsning: Mængden af opløst opløst stof har endnu ikke nået opløselighedskoefficienten. Dette betyder, at mere opløst stof kan tilføjes.
- overmættet opløsning: Der er mere opløst opløst stof end under normale forhold. I dette tilfælde præsenterer de et bundfald.
For at lære mere om løsninger, læs følgende tekster.:
- Fortynding af opløsninger
- Molalitet
- Molaritet
- Titrering
Koncentration af løsninger
Fra opløsningsmidlet og opløsningsmidlet er det muligt at beregne koncentrationen af en opløsning.
Fælles koncentration defineres som forholdet mellem massen af opløst stof opløst i et givet volumen opløsning.
Koncentrationsberegning udføres ved hjælp af følgende formel:
At være,
Ç: Koncentration (g / l);
m: masse af opløst stof (g);
V: opløsningsvolumen (L).
Eksempel:
(Faap) Beregn koncentrationen, i g / l, af en vandig opløsning af natriumnitrat indeholdende 30 g salt i 400 ml opløsning:
Løsning:
Overhold oplysningerne om mængden af opløst stof og opløsningsmiddel. Der er 30 g salt (opløst stof) i 400 ml vandig opløsning (opløsningsmiddel).
Volumenet er dog i ml, og vi skal omdanne det til L:
For at kende koncentrationen skal du bare anvende formlen:
Med dette resultat nåede vi den konklusion, at når vi blander 30 g salt med 400 ml vand, får vi en opløsning med en koncentration på 75 g / L.
For mere information om, hvordan man beregner den fælles koncentration, vil disse tekster være nyttige.:
- Opløsningskoncentration
- Øvelser på fælles koncentration


