Hybridisering af sp-type kulstof2 det sker, når det har en dobbeltbinding og to enkeltbindinger eller en pi-binding (π) og tre sigma-bindinger (σ). Faktisk sp hybridisering2 det skabes mellem atomerne, der etablerer dobbeltbindingen.
Et eksempel på et sådant molekyle er formaldehyd (CH2O). Bemærk dens struktur nedenfor:
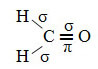
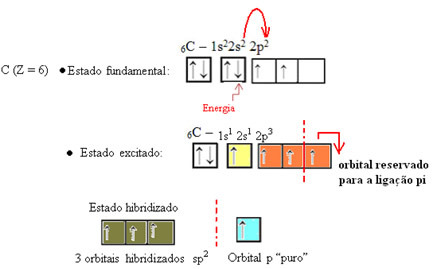
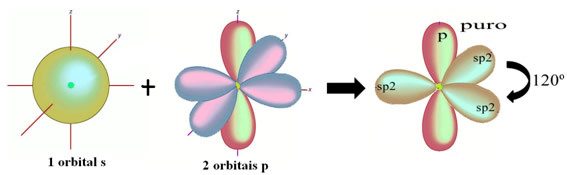
Som det ses i teksten "sp-type hybridisering3”, Carbon hybridisering opstår, når en elektron fra underniveau 2s modtager energi og“ transporteres ”til 2p subniveau og stammer således fra 4 hybridiserede orbitaler fra "blandingen" af atomorbitaler ren.
I tilfælde af formaldehyd ved vi, at der vil være en pi-binding, så en af disse hybridiserede orbitaler er forbeholdt denne binding, mens de andre tre udfører sigma-bindinger:
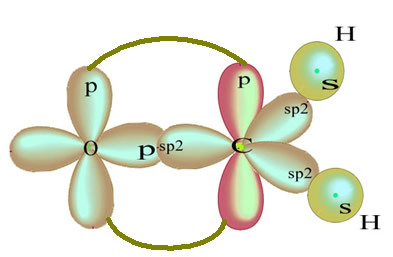
Brintatomerne, der danner enkeltbinding med kulstof, gør det med deres orbital:
Den resterende "rene" p-orbital dobbeltbinder iltatomet og formaldehydmolekylet har følgende struktur:
Hvad angår typen af obligationer, der findes i denne formaldehydstruktur, har vi:

Forbindelser: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm

