Den tredje lov om termodynamik behandler materiens opførsel med en entropi, der nærmer sig nul.
Ifølge denne lov, når et system er i termodynamisk ligevægt, nærmer dets entropi nul.
Den anden lov om termodynamik vedrører entropi. Efterfølgende vises den tredje lov som en forsøg på at etablere et absolut referencepunkt, der bestemmer entropi.
Walther Nernst (1864-1941) var fysikeren, der beskæftigede sig med de principper, der dannede grundlaget for den tredje lov om termodynamik.
Ifølge Nernst ville entropi have en minimumsværdi, hvis temperaturen på et rent stof var lig med eller nærmer sig absolut nul.
Til det foreslog Nernst nedenstående formel, som viser, at variationen af entropi (AS) og temperatur (T) har tendens til minimumsværdier, det vil sige 0:
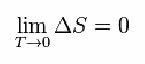
Men hvad er Entropy?
Entropi det er den måde, molekyler organiserer sig på i systemet. Denne organisation oversættes til forstyrrelse, ikke i form af forvirring, men i form af bevægelse og agitation af molekyler.
Jo flere molekyler kan bevæge sig, jo mere uorganiserede er de, jo mere entropi har de.
Oprindeligt foreslog Nernst, at entropien, han foreslog, kun ville være mulig på perfekte krystaller.
Endelig konkluderede han, at temperaturen lig med absolut nul ikke eksisterede, hvilket gør den tredje lov til en kontroversiel lov.
Så for mange fysikere er dette ikke en lov, men en regel.
Efter så mange år (siden 1912) forsøger forskere at opnå denne temperatur eller temperaturer, der kommer tættere og tættere på absolut nul. Således opdagede de, at det kun er muligt i gasser, hvor ethvert stof bortskaffes i fast eller flydende tilstand.
Læs også:
- Nul lov om termodynamik
- Første lov om termodynamik
- Anden lov om termodynamik
- Øvelser på termodynamik