Grafen er et nanomateriale, der kun består af kulstof, hvor atomer binder sammen og danner sekskantede strukturer.
Det er den fineste kendte krystal, og dens egenskaber gør den yderst ønskelig. Dette materiale er let, ledende af elektricitet, stift og vandtæt.
Anvendeligheden af grafen er inden for flere områder. De mest kendte er: civil byggeri, energi, telekommunikation, medicin og elektronik.
Siden det blev opdaget, har grafen været centrum for forskningsinteresse. Undersøgelsen af ansøgninger om dette materiale mobiliserer institutioner og investeringer på millioner af euro. Så videnskabsmænd rundt om i verden prøver fortsat at udvikle en billigere måde at producere den på i stor skala.
Forståelse hvad grafen er
Grafen er en allotrop form for kulstof, hvor arrangementet af atomerne i dette element danner et tyndt lag.
Denne allotrop er todimensionel, det vil sige, den har kun to målinger: bredde og højde.
For at få en idé om størrelsen på dette materiale svarer tykkelsen på et ark papir til superpositionen af 3 millioner lag grafen.
Selv om det er det tyndeste materiale, der er isoleret og identificeret af mennesker, er dets dimension i størrelsesordenen nanometer. Det er let og stærkt, i stand til at lede elektricitet bedre end metaller som kobber og silicium.
Det arrangement, som kulstofatomer antager i strukturen af grafen, gør, at der findes meget interessante og ønskelige egenskaber i det.
Grafen applikationer
Mange virksomheder og forskningsgrupper rundt om i verden offentliggør resultater af arbejde, der involverer applikationer til grafen. Se nedenfor de vigtigste.
| Drikkevand | Grafenformede membraner er i stand til at afsalte og rense havvand. |
|---|---|
| CO-emissioner2 | Grafenfiltre er i stand til at reducere CO -emissioner2 ved at adskille gasser genereret af industrier og virksomheder, der vil blive afvist. |
| sygdomsopdagelse | Meget hurtigere biomedicinske sensorer er baseret på grafen og kan detektere sygdomme, vira og andre toksiner. |
| Konstruktion | Byggematerialer som beton og aluminium gøres lettere og stærkere med tilsætning af grafen. |
| Skønhed | Hårfarvning ved sprøjtning af grafen, hvis varighed vil være omkring 30 vasker. |
| Mikroenheder | Chips endnu mindre og stærkere på grund af udskiftning af silicium med grafen. |
| Energi | Solceller har bedre fleksibilitet, mere gennemsigtighed og lavere produktionsomkostninger ved brug af grafen. |
| Elektronik | Batterier med bedre og hurtigere energilagring kan genoplades på op til 15 minutter. |
| Mobilitet | Cykler kan have fastere dæk og stel, der vejer 350 gram ved hjælp af grafen. |
Grafenstruktur
Strukturen af grafen består af et netværk af carbonatomer forbundet i sekskanter.
Kulstofkernen består af 6 protoner og 6 neutroner. Atomets 6 elektroner er fordelt i to lag.
På valenslag der er 4 elektroner, hvor denne skal holder op til 8. Derfor, for at kul kan opnå stabilitet, skal det oprette 4 forbindelser og nå den elektroniske konfiguration af ædelgas, som angivet i oktetreglen.
Atomer i grafen binder sig ved kovalente bindingerder er deling af elektroner.

Kulstof-kulstofbindinger er de stærkeste bindinger, der findes i naturen, og hvert kulstof forbinder de andre 3 i strukturen. Derfor er hybridiseringen af atomet sp2, hvilket svarer til 2 enkelt- og en dobbeltbinding.
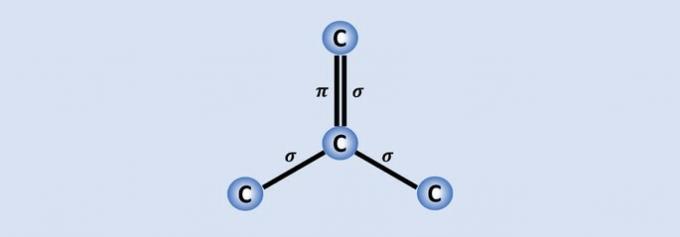
Af de 4 kulstofelektroner deles tre med de nærliggende atomer og et, der udgør bindingen. , hjælper grafen for eksempel med at være en god leder af elektricitet, fordi den har mere "frihed" i materialet.
Grafenegenskaber

| Lys | En kvadratmeter vejer kun 0,77 milligram. En grafen-aerogel er ca. 12 gange lettere end luft. |
|---|---|
| Fleksibel | Det kan udvide op til 25% af dets længde. |
| Leder | Dens nuværende densitet er højere end kobber. |
| Holdbar | Det ekspanderer i kulde og krymper i varme. De fleste stoffer virker på den modsatte måde. |
| Vandtæt | Masken dannet af kulstoffer tillader ikke engang passage af et heliumatom. |
| Modstandsdygtig | Cirka 200 gange stærkere end stål. |
| Gennemsigtig | Absorberer kun 2,3% af lyset. |
| Tynd | En million gange tyndere end et menneskehår. Dets tykkelse er kun et atom. |
| Hårdt | Det hårdeste kendte materiale, endnu mere end diamant. |
Historie og opdagelse af grafen
Udtrykket grafen blev først brugt i 1987, men blev kun officielt anerkendt i 1994 af União de Química Pure and Applied.
Denne betegnelse opstod fra krydset i grafit med suffikset -ene, der henviser til stoffets dobbeltbinding.
Siden 1950'erne talte Linus Pauling i sine klasser om eksistensen af et tyndt lag kulstof, der består af sekskantede ringe. Philip Russell Wallace beskrev også nogle vigtige egenskaber ved denne struktur år tidligere.
Men først for nylig, i 2004, blev grafen isoleret af fysikere Andre Geim og Konstantin Novoselov ved University of Manchester og kan være dybt kendt.
De studerede grafit og ved hjælp af teknikken til mekanisk eksfoliering lykkedes det at isolere et lag af materialet ved hjælp af tape. Denne præstation tildelte Nobelprisen til parret i 2010.
Betydningen af grafen for Brasilien
Brasilien har en af de største reserver af naturlig grafit, et materiale der indeholder grafen. Grafiske naturreserver når 45% af verdens samlede.
Selvom forekomsten af grafit observeres i hele det brasilianske territorium, findes de udnyttede reserver i Minas Gerais, Ceará og Bahia.
Med rigeligt råmateriale investerer Brasilien også i forskning i området. Det første laboratorium i Latinamerika dedikeret til forskning med grafen er placeret i Brasilien på Universidade Presbiteriana Mackenzie i São Paulo, kaldet MackGraphe.
Grafenfremstilling
Grafen kan fremstilles ud fra carbid, carbonhydrid, carbon nanorør og grafit. Sidstnævnte er det mest anvendte som udgangsmateriale.
De vigtigste metoder til produktion af grafen er:
- Mekanisk mikroeksfoliering: En grafitkrystal har lag af grafen fjernet ved hjælp af et bånd, der aflejres på substrater indeholdende siliciumoxid.
- Kemisk mikroeksfoliering: kulstofbindinger svækkes ved tilsætning af reagenser, der delvis bryder netværket.
- kemisk dampaflejring: dannelse af grafenlag aflejret på faste understøtninger, såsom metallisk nikkeloverflade.
Grafenpris
Vanskeligheden ved at syntetisere grafen i industriel skala betyder, at værdien af dette materiale stadig er meget høj.
Sammenlignet med grafit er prisen tusindvis af gange højere. Mens der sælges 1 kg grafit for 1 dollar, sælges 150 g grafen for 15.000 dollars.
Nysgerrigheder omkring Graphene
- EU-projekt, navngivet Grafen Flagskib, øremærket omkring 1,3 milliarder euro til forskning relateret til grafen, applikationer og produktionsudvikling i industriel målestok. Cirka 150 institutioner i 23 lande deltager i dette projekt.
- Den første kuffert, der er udviklet til rumrejser, har grafen i sin sammensætning. Dens lancering er planlagt til 2033, når NASA planlægger at gennemføre ekspeditioner til Mars.
- Borophene er grafens nye konkurrent. Dette materiale blev opdaget i 2015 og betragtes som en forbedret version af grafen, der er endnu mere fleksibelt, modstandsdygtigt og ledende.
Grafen i Enem
I Enem 2018-testen var et af spørgsmålene om Naturvidenskab og dets teknologier handlede om grafen. Tjek nedenfor den kommenterede løsning på dette problem.
Grafen er en allotrop form for kulstof, der består af et plan ark (todimensionalt array) af komprimerede kulstofatomer, der kun er ét atom tykt. Dens struktur er sekskantet, som vist på figuren.
I dette arrangement har carbonatomer hybridisering
a) sp af lineær geometri.
b) sp2 af plan trigonal geometri.
c) sp3 alterneret med sp-hybridiserede carbonatomer med lineær geometri.
d) sp3d af plan geometri.
e) sp3d2 med sekskantet plan geometri.
korrekt alternativ: b) sp2 af plan trigonal geometri.
Kulstofototropi opstår på grund af dets evne til at danne forskellige enkle stoffer.
Fordi det har 4 elektroner i valensskallen, er kulstof tetravalent, dvs. det har tendens til at danne 4 kovalente bindinger. Disse obligationer kan være enkelt, dobbelt eller tredobbelt.
Afhængigt af de bindinger, som kulstof danner, ændres den rumlige struktur af molekylet til det arrangement, der bedst rummer atomerne.
Hybridisering opstår, når der er en kombination af orbitaler, og for kulstof kan det være: sp, sp2 og sp3afhængigt af typen af opkald.
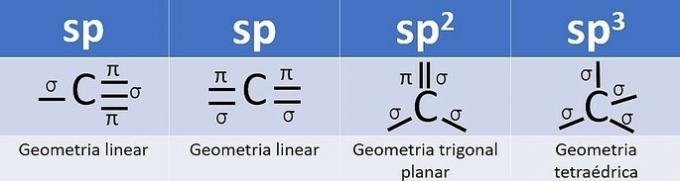
Antallet af hybridorbitaler er summen af de sigma (σ) bindinger, som kulstoffet danner, da bindingen ikke hybridiserer.
- sp: 2 sigma-links
- sp2: 3 sigma links
- sp3: 4 sigma-links
Repræsentationen af grafenallotropen i kugler og pinde, som vist i figuren i spørgsmålet, viser ikke stoffets sande bindinger.
Men hvis vi ser på en del af billedet, ser vi, at der er et kulstof, der repræsenterer en kugle, der forbinder med tre andre carbonatomer, der danner en struktur som en trekant.
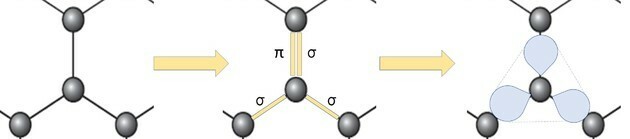
Hvis kulstof har brug for 4 bindinger og er bundet til 3 andre carbonatomer, er en af disse bindinger dobbelt.
Fordi den har en dobbelt og to enkeltbindinger, har grafen sp-hybridisering2 og følgelig trigonal plan geometri.
De andre kendte allotrope former for kulstof er: grafit, diamant, fulleren og nanorør. Selvom de alle er lavet af kulstof, har allotropes forskellige egenskaber, der stammer fra deres forskellige strukturer.
Læs også: Kemi i enem og Kemispørgsmål i fjende.