Ioniseringsenergi er en periodisk egenskab, der angiver den nødvendige energi til at overføre elektronen fra et atom i jordtilstand.
Et atom er i dets jordtilstand, når dets antal protoner er lig med antallet af elektroner.
Overførslen af elektron (er) fra atomet kaldes ionisering. Derfor kaldes den energi, der er nødvendig for at det skal ske, ioniseringsenergi, også kendt som Ioniseringspotentiale.
Den første fjernede elektron er den, der er længst væk fra atomkernen. Afstanden letter overførslen, fordi jo længere væk fra kernen, hvilket er positivt, jo mindre energi tager det for elektronen at blive taget ud af den.
De næste elektroner har brug for mere energi. Således kan vi sige, at den første ioniseringsenergi (E.I) er mindre end den 2. ioniseringsenergi. Den anden er til gengæld mindre end den 3. ioniseringsenergi og så videre:
1. E.I
Dette skyldes, at atomstråle den øges i størrelse, når hver elektron fjernes fra atomet. Som et resultat kommer elektroner tættere og tættere på atomkernen.
Kontroller de successive iltioniseringsenergier:
O -> O+: 1313,9 kJ mol-1
O+1 -> O+2: 3388,2 kJ mol-1
O+2 -> O+3: 5300,3 kJ mol-1
O+3 -> O+4: 7469,1 kJ mol-1
O+4 -> O+5: 10989,3 kJ mol-1
Når atomet efter fjernelse af en elektron har flere protoner end elektroner, bliver det atom til et kation.
Læs også:
- Ion, kation og anion
- ionisering
Dette er f.eks. Hvad der sker, når vi fjerner en elektron fra brint. Brint består af 1 proton og 1 elektron.
Efter fjernelse af elektronen har brintet kun en proton i sin kerne. Det betyder, at brintet blev ioniseret, og at det blev en kation, hvilket er det samme som at sige, at det blev en positiv ion.
Ioniseringsenergi i det periodiske system
Atomradien øges fra højre til venstre og top til bund på det periodiske system.
Når man ved dette, stiger ioniseringsenergien i den modsatte retning, dvs. den er større fra venstre mod højre og fra bund til top.
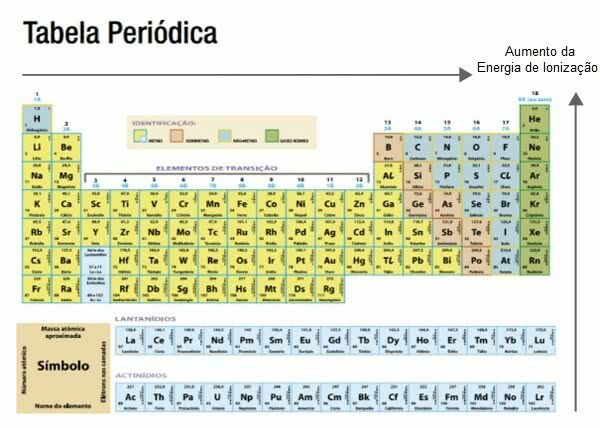
Blandt de elementer, der har brug for mindre ioniseringsenergi, er alkalimetallerfor eksempel kalium.
Ædle gasser er generelt dem, der kræver en højere ioniseringsenergi, for eksempel argon.
Fjernelsesenergi x ioniseringsenergi
Fjernelsesenergi ligner meget ioniseringsenergi. Forskellen mellem de to er, at fjernelsesenergien kan associeres med fotoelektriske effekter.
Fotoelektriske effekter er elektroner, der normalt udsendes af metalliske materialer udsat for lys.
Som et resultat følger fjernelsen af elektroner ikke i en fjernelsesenergi, som det sker med ioniseringsenergien, i fjernelsesenergien.
I ioniseringsenergi er de første elektroner, der fjernes, de fjerneste fra kernen.
Elektronisk affinitet
DET elektronisk affinitet det påvirker også atomenes opførsel, men omvendt.
Dette er den periodiske egenskab, der indikerer den frigivne energi, når et atom modtager en elektron. På den anden side er ioniseringsenergi den nødvendige energi til at fjerne en elektron fra et atom.
Læs også elektropositivitet og elektronegativitet.
Øvelser
1. (PUCRS) I betragtning af elementernes placering i det periodiske system er det korrekt at anføre, at blandt elementerne, der er anført nedenfor, er den med den mindste radius og den højeste ioniseringsenergi den
a) aluminium
b) argon
c) fosfor
d) natrium
e) rubidium
b) argon
2. (UEL) I periodisk klassificering øges ioniseringsenergien af kemiske grundstoffer
a) fra enderne til midten i perioder.
b) fra enderne til centrum, i familier.
c) fra højre til venstre i perioder.
d) fra top til bund i familier.
e) fra bund til top, i familier.
e) fra bund til top, i familier.
3. (Uece) Lad følgende neutrale atomer være repræsenteret af de hypotetiske symboler X, Y, Z og T og deres respektive elektroniske konfigurationer:
X → 1s2
Y → 1s2 2s2
Z → 1s2 2s2 2p6 3s2 3p6
T → 1s2 2s2 2p6 3s2 3p6 4s2
Den med den højeste ioniseringsenergi er:
a) Y
b) Z
c) T
d) X
d) X
4. (Ufes) Den første ioniseringsenergi af brom (Z = 35) er 1.139,9 kJ / mol. Kontroller alternativet, der indeholder de første ioniseringsenergier af henholdsvis fluor (Z = 9) og klor (Z = 17) i kJ / mol.
a) 930,0 og 1,008,4
b) 1.008,4 og 930.0
c) 1.251,1 og 1.681.0
d) 1.681,0 og 1.251,1
e) 1.251,0 og 930.0
d) 1.681,0 og 1.251,1
Tjek spørgsmål til optagelseseksamen med en kommenteret opløsning i: Øvelser på det periodiske system.