Nogle forbindelser har i deres struktur dobbeltbindinger alternerende med enkeltbindinger. Den mest berømte af dem alle er benzen, hvis struktur blev foreslået i 1865 af den tyske kemiker Friedrich August Kekulé (1829-1896). Dens struktur ville være cyklisk og dannet af tre dobbeltbindinger afbrudt med tre enkeltbindinger, som vist i nedenstående figurer:
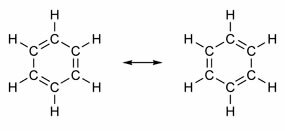
Begge måder at repræsentere benzen er acceptable, da det er muligt at ændre elektronerne i π-bindingerne uden at ændre atomernes position. Imidlertid repræsenterer hverken nøjagtigt hvad han er eller forklarer sin opførsel. Det skal opføre sig som en alken og fremkalde additionsreaktioner, men i praksis sker dette ikke. Benzen er ret stabil og fungerer som om den ikke har dobbeltbindinger; det giver substitutionsreaktioner som i alkaner.
I 1930 foreslog den amerikanske videnskabsmand Linus Pauling resonansteorien, der forklarede denne tilsyneladende modsætning. Denne teori sagde:
”Hver gang vi i en strukturformel kan ændre elektronernes position uden at ændre atomernes position, den virkelige struktur ingen vil ikke være nogen af de opnåede strukturer, men snarere en resonanshybrid af disse strukturer. ”
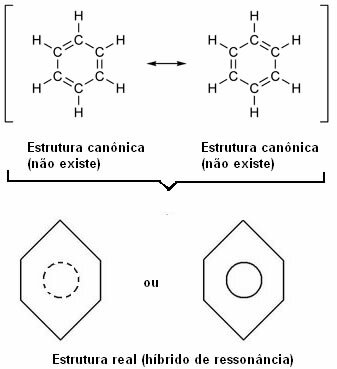
Denne effekt fremgår af størrelsen af kulstofbindingerne og afstanden mellem dem. Denne afstand er mellemliggende for enkeltbindingens (1,54 Å) og den for dobbeltbinding (1,34 Å); er derfor 1,39 Å på grund af resonanseffekten.
Denne effekt kan også ses i ozonmolekylets struktur (O3), som vist nedenfor:
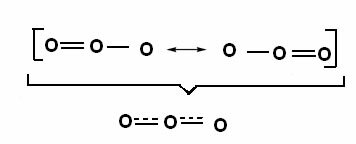
Kanoniske strukturer og ozonresonanshybrider.
Af Jennifer Fogaça
Uddannet i kemi
Brazil School Team.
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm


