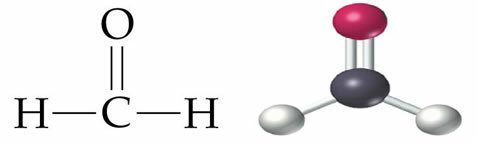Organiske forbindelser er molekylære, det vil sige at deres atomer bærer kovalente bindinger med hinanden. Når vi analyserer bindingerne mellem carbonatomer, som kan være enkle, dobbelte eller tredobbelte, observerer vi, at de er ikke-polære bindinger, da der ikke er nogen forskel i elektronegativitet mellem atomerne, da de hører til det samme element.
Da brint og kulstof desuden har en meget lille forskel i elektronegativitet, er bindingerne mellem dem også ikke-polære.
Ikke-polære forbindelser:

Med det kan vi konkludere, at Kulbrinter (organiske forbindelser, der kun har kulstof- og brintatomer) er ikke-polære molekyler. I disse forbindelser er den intermolekylære interaktion af den inducerede dipoltype, som er den svageste, der findes.
Da de er svage, er disse interaktioner lette at bryde. På grund af dette, koge- og smeltetemperaturerne for kulbrinter er lavere end for andre funktioner.

Sammenligning af kulbrinter, kogepunkter vil stige, når molær masse også øges.
For eksempel er ethan og butan begge alkaner. Se kogepunkterne for hver bestemt eksperimentelt:

Bemærk, at kogetemperaturen for butan er meget højere end etanens, da dens molære masse også er højere.
Når vi nu sammenligner kulbrinter, der har den samme molære masse (de er isomerer), men som har forskellige typer kulstofkæder, indser vi, at jo større antal grene, jo lavere kogetemperatur, fordi strukturen af molekylet bliver mere kompakt, dvs. dens overflade falder.
Stop ikke nu... Der er mere efter reklamen;)
Alle alkaner nedenfor har den samme molekylformel, C5H12, men deres kogetemperaturer er forskellige:

Bemærk, at neopentans kogetemperatur er den laveste, da den har flere grene.
Vi kan overveje, at de andre organiske funktioner er afledt af carbonhydrider ved erstatning af et eller flere hydrogener med atomer eller grupper af atomer i andre grundstoffer. Generelt har de andre organiske funktioner ilt eller nitrogen, som er mere elektronegative grundstoffer end kulstof. De tiltrækker stærkere det elektronpar, der deles med kulstof, og gør derfor molekylet polært:
Polære forbindelser:

Aldehyder, ketoner og organiske halogenider har højere kogepunkter end kulbrinter, fordi deres intermolekylære interaktion er den permanente dipol, som er stærkere end den for induceret dipol.
Alkoholer, carboxylsyrer og aminer har derimod endnu højere kogetemperaturer, da de udfører hydrogenbindinger, den mest intense type intermolekylær interaktion.
For forbindelser med alle disse funktioner gælder det samme som vi så for kulbrinter:

Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Polaritet og kogetemperatur for organiske forbindelser"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm. Adgang til 28. juni 2021.