Isomerisme det er et naturligt fænomen, hvor forskellige stoffer (med hensyn til kemiske og fysiske egenskaber) har nøjagtig den samme molekylformel, som i følgende eksempel:
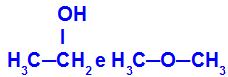
Forskellige stoffer, der har den samme molekylformel
Ethanol (til venstre) har molekylformlen C2H6O, som også forekommer med methoxyethan (til højre), så de er isomerer.
Typer af isomerisme
→ flad isomer
Det er den type isomerisme, der studerer de strukturelle forskelle mellem isomerer.
Det) Beskæftigelse
Det er den type flad isomerisme, hvor forskellen mellem stoffer er baseret på forskellen mellem de organiske funktioner, som de hører til. Se nogle eksempler:
Propanon og propan:
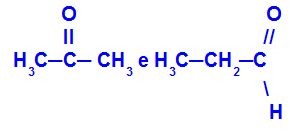
Isomerer, der tilhører forskellige funktioner
Propanon (venstre) tilhører ketongruppen, og propanal (højre) tilhører aldehydgruppen.
B) Fængsel
Det er den type flad isomerisme, hvor forskellen mellem stoffer er baseret på forskellen mellem de kæder, de præsenterer. Se et eksempel:
2-methyl-propan og butan
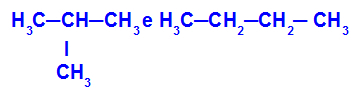
Isomerer, der har kæder med forskellige klassifikationer
I eksemplet kan vi se, at 2-methyl-propan (til venstre) har en forgrenet kæde, og butan (til højre) har en normal kæde.
ç) Position
Det er typen af flad isomerisme, hvor forskellen mellem stoffer er baseret på forskellen i position for en komponent, der er til stede i deres kæder. Se et eksempel:
1-chlor-propan og 2-chlor-propan
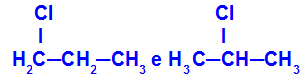
Isomerer, der har komponenter på forskellige positioner i kæden
I eksemplet kan vi se, at 1-chlor-propan (til venstre) har klor placeret på kulstof 1, og 2-chlor-propan (til højre) har klor placeret på kulstof 2.
d) Metameria eller kompensation
BEMÆRK: Isomer er udelukkende gyldigt for heterogene strenge.
Det er typen af flad isomerisme, hvor forskellen mellem stofferne er baseret på forskellen i position af et heteroatom til stede i deres kæder. Se et eksempel:
Eksempel: Methoxypropan og ethoxyethan
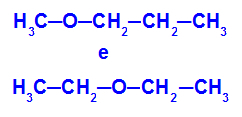
Isomerer, der har heteroatomer i forskellige positioner i kæden
I eksemplet kan vi se, at ilt i methoxypropan (til venstre) har en radikal med et kulstof på den ene side og tre carbonatomer på den anden. I ethoxyethan (til højre) har ilt et radikal med to carbonatomer på den ene side og to carbonatomer på den anden.
og)Automater
Det er et særligt tilfælde af isomeri af planfunktion og forekommer kun i tre organiske funktioner:
Aldehyd
keton
Enol
Denne type isomerisme fungerer på det faktum, at der er en kemisk balance mellem en enol og et aldehyd og mellem en enol og en keton, dvs. disse komponenter omdannes konstant til hinanden. Se et eksempel:
Prop-2-en-1-ol og propanon
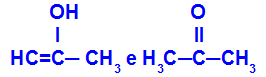
Isomerer, der tilhører forskellige funktioner
I eksemplet kan vi se, at Prop-2-en-1-ol (til venstre) tilhører gruppen af enoler, og propanon (til højre) tilhører gruppen ketoner, så de er isomerer af tautomery.
→ Rumisomerisme
Det er en type isomerisme defineret af den rumlige analyse af molekylet.
a) Geometriske isomerer
Stop ikke nu... Der er mere efter reklamen;)
Det er en type rumlig isomerisme, der opstår, når stoffet har molekyler med følgende egenskaber:
Lukket kæde, der har to carbonatomer med to forskellige ligander, som i eksemplet nedenfor:

Lukket struktur med geometrisk isomerisme
Åben kæde, der har en dobbeltbinding mellem carbonatomer, og i hver af disse carbonatomer i dobbeltbindingen er der to forskellige ligander, som i eksemplet nedenfor:
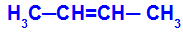
Åben struktur med geometrisk isomerisme
Geometrisk isomerisme er opdelt i to grupper:
1O Gruppe: cis-trans
Det sker, når de to ligander af det ene carbon er strengt lig med de to ligander af det andet carbon, hvad enten det er i den åbne struktur eller i den lukkede struktur.
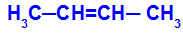
Kæde af et stof, der har cis-trans isomerisme
Isomeren kaldes cis, når de samme ligander er i samme plan.

Eksempel på en cis-isomer
Isomeren kaldes trans, når de forskellige ligander er i samme plan.

Eksempel på en trans-isomer
2O Gruppe: E-Z
Det sker, når de to ligander af det ene carbon er forskellige i forhold til de to ligander af det andet carbon, enten i den åbne struktur eller i den lukkede struktur.

Kæde af et stof, der har E-Z-isomerisme
Isomeren kaldes E, når liganderne med det højeste atomnummer er i modsatte plan. I eksemplet nedenfor har kulstof til venstre Br med det højeste atomnummer (35), og i det andet er der ilt (8).
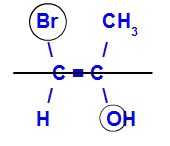
Eksempel på en E-isomer
Isomeren kaldes Z, når liganderne med det højeste atomnummer er i samme plan. I eksemplet nedenfor har kulstof til venstre Br med det højeste atomnummer (35), og i det andet er der ilt (8).

Eksempel på en Z-isomer
B) optisk isomer
Det er en type rumlig isomerisme, der kun forekommer, hvis stoffet har molekyler med chiralt kulstof (den der har fire forskellige ligander) i deres strukturer. Molekylet med chiralt kulstof har evnen til at polarisere og afbøje lys som følger:
Til højre (højre isomer)
Til venstre (levorotatorisk isomer)
En forbindelse med optisk aktivitet har altid gjort aktive isomerer (kaldet optiske antipoder) og inaktive isomerer (blanding mellem to aktive isomerer, en blanding kaldet racemisk).
Vi kan bruge følgende formel til at bestemme antallet af aktive (IOA) og inaktive (IOI) isomerer af en forbindelse, der har chiralt kulstof:
IOA = 2ingen
IOI = 2ingen
2
Nedenfor er et eksempel på en forbindelse, der har geometrisk isomerisme:
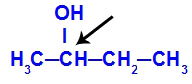
Kiralt kulstof med butan-2-ol
Strukturen af butan-2-ol har følgende ligander:
Methyl (CH3)
Ethyl (CH3-CH2)
Brint (H)
Hydroxyl (OH)
Fordi det kun har et chiralt kulstof, har butan-2-ol derfor:
Aktive isomerer:
IOA = 21
IOA = 2
Inaktive isomerer:
IOI = 21
2
IOI = 2
2
IOI = 1
Af mig Diogo Lopes Dias
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
DAGE, Diogo Lopes. "Hvad er isomerisme?"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Adgang til 27. juni 2021.

