I teksten "geometrisk isomer eller cis-trans”Blev vist, hvordan geometrisk rumlig isomerisme eller cis-trans. Kort fortalt er isomeren cis svarer til forbindelser, hvis lige ligander på hvert carbonatom er i samme plan; allerede i isomeren trans, de er på hver sin side.
Dette identificeres ved oprindelsen af disse udtryk, der kommer fra latin, hvor cis betyder "ved siden af" og trans "et kors".
Denne nomenklatur er meget nyttig, når to carbonatomer hver kun har to forskellige ligander. Imidlertid kan disse udtryk være tvetydige, når der henvises til alkener, hvis dobbeltbundet carbonatomer har mere end to forskellige ligander i sættet.
Overvej for eksempel forbindelsen nedenfor:

Bemærk, at på kulstof x den laveste atomantal er ligand CH3og på kulstof y er H. Men hvis vi skulle sige, at denne forbindelse er isomeren cis, kunne følgende spørgsmål opstå: hvordan er han cis hvis de sammenkædende grupper er ens (CH3) er på modsatte sider?
For at undgå denne tvetydighed er det mere korrekt at bruge i disse tilfælde nomenklaturen E-Z, hvor bogstavet E kommer fra det tyske ord
entgegen, hvilket betyder "modsætninger" og Z kommer fra det tyske ord zusammen, hvilket betyder "sammen". Denne nomenklatur følger følgende regel:
Anvendelse af denne prioritetsregel på 2-chlor-2-en, vi har det i kulstof x liganden med det højeste atomnummer er Cl og på carbon y er CH3. Således har vi følgende isomerer:
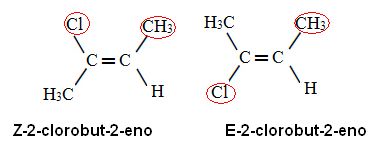
I det første tilfælde er liganderne med de højeste atomnumre på samme side af planet (Z) og i det andet er de på modsatte sider (E).
Dette sker også med cykliske forbindelser. Det er vigtigt at huske, at det ikke er korrekt at relatere termerne cis og Z, og trans og E, da de er forskellige navngivningssystemer.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/isomeria-e-z-no-lugar-cis-trans.htm

