En oxidationsreduktionsreaktion er karakteriseret som en samtidig proces med tab og forstærkning af elektroner, da elektronerne, der er tabt af et atom, ion eller molekyle, straks modtages af andre.
For at forstå, se et eksempel:
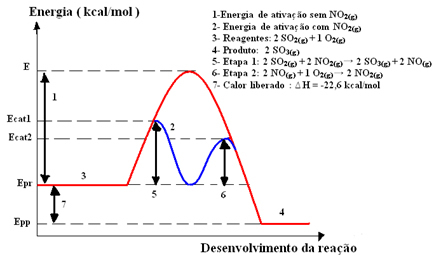
En kobbersulfatopløsning (CuSO4 (aq)) er blå på grund af tilstedeværelsen af Cu-ion2+ opløst i det. Hvis vi lægger en metalzinkplade (Zn(s)) i denne opløsning over tid vil vi muligvis bemærke to ændringer: opløsningens farve bliver farveløs, og en metallisk kobberaflejring vises på zinkpladen.
Derfor er reaktionen, der forekommer i dette tilfælde, som følger:
Zn(s) + CuSO4 (aq) → Cu(s) + ZnSO4 (aq)
eller
Zn(s) + Cu2+(her) + OS42-(her) → Cu(s) + Zn2+(her) + OS42-(her)
eller endnu
Zn(s) + Cu2+(her) → Cu(s) + Zn2+(her)
Bemærk, at der var en overførsel af elektroner fra zink til kobber. Analyseret isoleret den transformation, der opstod i hvert af disse elementer, har vi:
- Zn(s) → Zn2+(her)
Zink mistede 2 elektroner, der gik fra metallisk zink til kation. I det tilfælde, zinket har gennemgået en oxidation.
- Røv2+(her) → Cu(s)
Med kobber skete det modsatte, det fik 2 elektroner, der passerede fra kobber II-kation til metallisk kobber. Kobber er reduceret.
Dette forklarer de to observerede ændringer, da opløsningen blev farveløs, fordi kobberionerne blev omdannet til metallisk kobber, som blev deponeret på zinkpladen.
Stop ikke nu... Der er mere efter reklamen;)
Da der var et samtidigt tab og forstærkning af elektroner, er denne reaktion et eksempel på en redoxreaktion, og gennem det kan vi etablere følgende begreber, der gentages for alle andre reaktioner på dette type:

Det mest reaktive metal gennemgår oxidationI det foreslåede eksempel er zink således mere reaktivt end kobber.
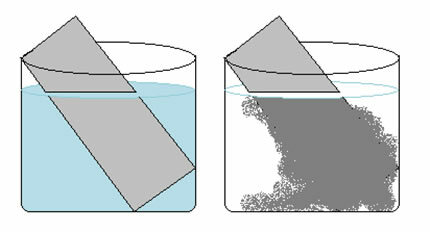
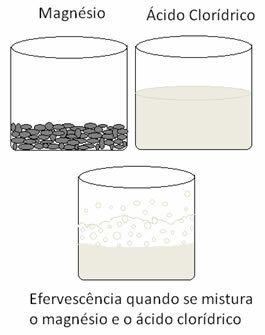
En anden redoxreaktion, der kan citeres, opstår, når vi lægger magnesium eller aluminium i en saltsyreopløsning. I disse reaktioner modtager hydrogen fra saltsyre 3 elektroner fra aluminium (eller 2 elektroner fra magnesium), der passerer det fra H-kation+ for brintgas (H2), mens metallet bliver kationen:
2 Al(s) + 6 H+(her) → 2 Al3+(her) + 3H2 (g)
mg(s) + 2 H+(her) → Mg2+(her) + H2 (g)
Metaller gennemgår oxidation, og brint gennemgår reduktion. Nedenfor er en figur, der viser, at tilsætning af magnesium til saltsyre forårsager en brusning, som skyldes frigivelse af brintgas, og magnesium forsvinder, som det er forbrugt.
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Oxidationsreaktioner"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm. Adgang til 28. juni 2021.
Kemi
Betjening af airbag, enhed designet til at beskytte drivere, elektrisk impuls, kemisk nedbrydningsreaktion, kollision, kemisk blanding af natriumazid, sensorer placeret på bilkofanger, alkalisilicat, gas kvælstof.
Kemi

Lysfølsomme linser, oxidationsreduktionsreaktioner, tab eller forstærkning af elektroner, fotosyntetiske linser i solbriller, sammensætning af fotokromatisk glas, tetraedriske iltatomer, krystalstruktur af sølvchlorid, ultraviolet lys, sølvmetal