Når vi taler om pH, henviser vi til det hydrogenioniske potentiale i en opløsning, det vil sige mængden af hydroniumkationer (H+ eller H3O+), som er dispergeret i opløsningsmidlet i en opløsning.
Hydroniumkationer er velkendte på grund af den definition, forskeren foreslår Arhenius for en syre. Denne forsker hævder det syre er ethvert stof i stand til ionisere og producerer hydroniumioner i et vandigt medium.
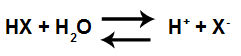
Syreionisering ligning
akronymet pH tjener som en reference til bestemmelse af surhedsgraden i et medium. Men i lang tid har kemikere også brugt pH som en reference til ud over surhed at bestemme, om et medium er basisk eller neutralt.
Dette er muligt, fordi kemikere nu er klar over, at vand gennemgår selvionisering, det vil sige, det producerer hydronium (H+) og hydroxider (OH-). Således har en vandig opløsning aldrig kun hydronium eller hydroxid, men begge dele, som vi kan se af følgende ligning:

Vand autoionisering ligning
Værdier brugt som reference for pH
De anvendte værdier til pH
henvises til ioniseringskonstanten (Kw) for vand ved en temperatur på 25OC, som er lig med 10-14. Ved denne temperatur er koncentrationerne af hydronium- og hydroxidioner produceret af vand absolut lige, det vil sige 10-7 mol / l.[H+] = [OH-]= 10-7
Fra denne reference ligger de anvendte værdier for pH fra 0 til 14.
Formler til beregning af pH
a) Beregning ud fra koncentrationen i mol / L af hydroniumkationer
Beregningen af pH-værdien kan foretages direkte, så længe vi kender koncentrationen af hydronium ([H+]). Se:
pH = -log [H+]
eller
10-pH = [H+]
b) Beregning ud fra koncentrationen af hydroxidanioner (OH-)
pOH = -log [OH-]
eller
10-OH = [OH-]
Efter beregning af pOH-værdien skal du bruge den i det følgende udtryk for at bestemme pH-værdien.
pH + pOH = 14
Fortolkning af pH-værdier
Når vi kender pH-værdien, kan vi bestemme, om den pågældende opløsning har en sur, basisk eller neutral karakter. Til dette skal du bare bruge følgende skematiske forhold:
For pH-værdier under 7 = surt medium;
For pH med en værdi lig med 7 = neutralt medium;
For pH-værdier over 7 = basisk medium.
Eksempler
1. eksempel: At vide, at koncentrationen af hydroniumkationer i en opløsning er 2,10-4 mol / L, hvad skal pH-værdien være af denne opløsning?
For at bestemme opløsningens pH-værdi ud fra hydroniumkoncentrationen (H+), 2.10-4 mol / L, skal vi bruge følgende udtryk:
pH = -log [H+]
pH = -log [2,10-4 ]
pH = - (log 2 + log 10-4)
pH = -log2 - log10-4
pH = –log 2 - 4.log 10
pH = –0,3 + 4. (1)
pH = -0,3 + 4
pH = 3,7
2. eksempel: En opløsning dannet af et bestemt opløst stof har en hydroxidionkoncentration lig med 10-11 mol / l. Fra denne koncentration kan vi sige, at pH i denne opløsning er værd hvor meget?
For at bestemme opløsningens pH-værdi ud fra hydroxidkoncentrationen, 10-11 mol / L, skal vi gøre følgende:
1O Trin: beregne pOH-værdien.
10-OH = [OH-]
10-OH = 10-11
Vi skal gange udtrykket med -1, fordi pOH altid er en ukendt positiv.
-pOH = -11. (- 1)
pOH = 11
2O Trin: beregne pH-værdien.
pH + pOH = 14
pH + 11 = 14
pH = 14 - 11
pH = 3
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ph.htm

