Siden oldtiden har mennesket været interesseret i at besvare spørgsmålet om materiens sammensætning.
Flere personligheder fra det videnskabelige samfund tog stilling til emnet, men det var først i slutningen af det 19. århundrede, at mysterierne om atomsammensætning begyndte at blive afsløret.
Den antikke filosof Leucippus mente for eksempel, at atomet bestod af små partikler.
Efter denne definition blev det foreslået af Democritus og Dalton, at atompartikler var massive og udelelige.
Denne kendsgerning blev senere bestridt af Thomson, en engelsk fysiker, der opdagede elektronens eksistens og derefter var i stand til at bekræfte den idé, som Leucipo tidligere havde foreslået.
Efter denne opdagelse præsenterede Thomson en model, hvor atomet blev dannet af en sfære med positive ladninger, og inde i kernen var der elektroner.
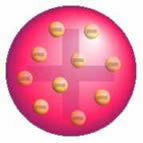
Thomsons Atom Model - I en positivt ladet, ensartet fordelt massesfære,
de ville være omgivet af negativt ladede elektroner, som i en budding.
Selv efter Thomsons teori havde atommodellen stadig en teoretisk-eksperimentel mangel, der kunne bevise dens rigtighed.
Emnet blev endnu en gang varmt diskuteret, da fysiker Rutherfords hold bemærkede, at der var en meget stor afvigelse (og uforklarlig, ifølge rosinpuddingsteorien) når nogle radioaktive alfapartikler passerede gennem et tyndt lag lamina metallisk.
Efter at have analyseret og studeret det faktum kom Rutherford til den konklusion, at atomets radius er 10.000 gange større end kernens radius.
Gennem hele studiet af atomet ankom Rutherford og hans team i 1911 til en atommodel, som de kaldte atomets planetmodel.
Stop ikke nu... Der er mere efter reklamen;)

I 1913 afkodede Niels Bohr atommodellen ved at anvende det kvantum af handling, som Planck opdagede i sine studier. Handlingskvantumet var faktisk det store jokertegn, der ville komme til at fuldføre og afklare atommodellen.
Bohr justerede effektivt og enkelt modellen præsenteret af Rutherford og nåede følgende konklusion:
Elektronen erhverver energi, som er repræsenteret gennem en defineret bane. De tilladte baner danner energiniveauerne.

Af Talita A. engle
Uddannet i fysik
Brazil School Team
Fysik Moderne - Fysik - Brasilien skole
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
ENGELER, Talita Alves dos. "Fra Rutherfords atom til Bohrs atom"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm. Adgang til 27. juni 2021.