“Kemisk binding ”var et udtryk, der først blev brugt af Gilbert Newton Lewis i år 1920 i en artikel for at forklare hvorfor at atomer holder sammen for at danne stoffer, og også hvorfor de holder sammen over tusinder af år gammel.
Atomer på de fleste kemiske grundstoffer, der hidtil er kendt og er opført i det periodiske system, vises ikke i isoleret form i naturen. De fleste af de materialer, der findes i vores daglige liv, er stoffer, der kan være enkle (bestående af atomer af kun en type kemisk grundstof) eller kompositter (har atomer med to eller flere kemiske grundstoffer mange forskellige).
Dette skyldes, at atomer har evnen til at danne kemiske bindinger med andre atomer, som kan være det samme element eller forskellige grundstoffer. Disse bånd er så stærke, at atomerne i de fleste tilfælde forbliver sammenføjede, som de er uden ekstern indflydelse.
Mind Map: Kemiske obligationer

* For at downloade tankekortet i PDF, Klik her!
For eksempel er det ikke almindeligt for os at finde et frit iltatom i naturen; dog finder vi flere stoffer, hvor det ser ud til at være bundet til andre atomer. Et eksempel på et simpelt stof er iltgas, hvor hvert molekyle er dannet af to bundne iltatomer (O
2); mens et eksempel på et sammensat stof er vand, hvor hvert molekyle har to hydrogenatomer bundet til et oxygenatom (H2O).De eneste elementer, der findes stabilt isoleret i naturen, er ædle gasserdet vil sige elementerne i familie 18 i det periodiske system (He, Ne, Ar, Kr, Xe og Rn). Alle disse grundstoffer har det til fælles, at de har otte elektroner i den sidste elektronskal (valenslag) med undtagelse af helium (He), som kun har en elektronskal (K-lag) og derfor har to elektroner, hvilket er det maksimalt mulige antal elektroner i det lag.
Således Gilbert N. Lewis og også videnskabsmand Water Kossel kom til den konklusion, at de andre grundstofers atomer binder til at have otte elektroner (eller to, hvis du kun har K-skallen) og stabiliserer sig således. Det blev skabt, så elektronisk teori om valens, som angiver, hvor mange kemiske bindinger et grundstofs atom danner, baseret på den forklarede idé.
Derfor, atomer danner kemiske bindinger, der søger at miste, vinde eller dele valensskalelektroner, indtil de når konfigurationen af den næste ædelgas.Denne teori blev også kaldt oktetregel.
For eksempel er ilt bivalent, fordi det har seks elektroner i sin valensskal. Derfor er det nødvendigt at modtage yderligere to elektroner for at have en konfiguration af ædelgasneonet (Ne), det vil sige med otte elektroner i valensskallen, som i dette tilfælde er L-skallen. I tilfælde af nævnte iltgas og vand har vi følgende:
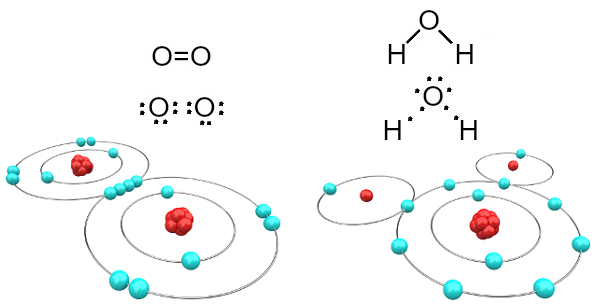
Oxygen- og vandmolekyler dannet af kovalente bindinger
Bemærk, at i det første tilfælde (iltgas - O2), deler hvert oxygenatom to elektroner, som begge har otte elektroner i valensskallen. Dette betyder, at en dobbeltbinding (to bindinger på samme tid mellem to atomer).
I tilfælde af vand deler hvert af de to brintatomer en elektron med det centrale iltatom og alle er stabile (ilt har otte elektroner i valensskallen, og hvert brint har to elektroner). Her foretages også to enkle forbindelser.
Denne type kemisk binding, hvor alle atomer har brug for at modtage elektroner (hydrogen, ikke-metaller og semimetaller), og hvor elektroner deles parvis, kaldes kovalent binding.
Men der er to flere typer kemiske bindinger:
(1) ionbinding → der er den endelige overførsel af elektroner fra et atom til et andet. Denne type binding opstår mellem metalatomer (som har en tendens til at miste elektroner for at blive stabile) og hydrogenatomer, ikke-metaller og halvmetaller (som har en tendens til at få elektroner til at blive stabil).
Et eksempel er natriumchlorid (NaCl - bordsalt), hvor natrium er et metal, der har en tendens til at miste en elektron, mens klor er et ikke-metal, der har en tendens til at få en elektron. Således donerer natrium(rød pil)en elektron til klor, der danner salt, et meget stabilt stof. Da de er uddannet (sort pil) ioner, som er kemiske arter med modsatte ladninger (+ og -), en ion tiltrækker en anden i nærheden, og ioniske klynger dannes med et stort antal ioner, ligesom krystaller i bordsalt.

Dannelse af natriumchlorid gennem ionbinding
(2) Metalforbindelse → Det er en teori om, at metaller (såsom aluminium, guld, sølv, kobber osv.) Dannes af en klynge af neutronatomer og kationer, der holdes sammen af en slags "sky" af frie elektroner (elektroner, der gik tabt i dannelsen af kationer citeret). Denne sky (eller hav) af elektroner ville fungere som en metallisk binding, der ville holde atomerne sammen.
For flere detaljer om disse typer kemiske bindinger samt oktetreglen, læs de relaterede artikler nedenfor.
Mind Map Af M.e Victor Ricardo Ferrreira
Kemi lærer
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-ligacao-quimica.htm

