Gas og damp
Forskellen mellem gas og damp gives fra den kritiske temperatur. Damp er stof i gasform, en tilstand, der kan kondenseres med stigende tryk. Gas er ikke det samme. Det er en væske, der ikke kan flydes med en simpel trykforøgelse. Dette adskiller gas fra damp.
Opførsel af gasser
Et givet stof i gasform er en gas, hvis dens temperatur er højere end den kritiske temperatur, hvis temperaturen er lig med eller lavere end den kritiske temperatur, er stoffet damp.
De virkelige gasser, som vi normalt kender, såsom helium, nitrogen og ilt, har forskellige og særlige molekylære egenskaber for hver enkelt. Men hvis vi sætter dem alle ved høje temperaturer og lave tryk, begynder de at vise meget lignende opførsel. I studiet af gasser vedtages en simpel teoretisk model, som i praksis ikke eksisterer med adfærd svarende til den for ægte gasser. Denne tilnærmelse bliver bedre, jo lavere tryk og jo højere temperatur. Denne gasmodel kaldes perfekt gas.
Omkring det 17. og 19. århundrede var der tre forskere (Jacques Charles, Louis J. Gay-Lussac og Paul E. Clayperon), efter at have undersøgt gassernes opførsel, uddybede love, der regulerer adfærden af perfekte gasser, også kaldet ideelle gasser. De love, der er bestemt af dem, fastlægger reglerne for den "eksterne" opførsel af den perfekte gas, hvilket fører til det tæller kun de fysiske størrelser, der er knyttet til dem, som er: volumen, temperatur og tryk.
Generel lov om perfekte gasser
Udtrykket, der bestemmer den generelle lov for perfekte gasser, kan ses som følger:
Stop ikke nu... Der er mere efter reklamen;)
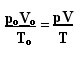
hvor sO, VO og TO er henholdsvis starttryk, startvolumen og starttemperatur. Dette er et udtryk, der bruges til, når variablerne for en gas varierer.
Boyles lov
Robert Boyle, fysiker og kemiker, var den, der bestemte loven, der styrer de transformationer, som en gas gennemgår, når temperaturen holdes konstant. Hans lov siger, at når en gas gennemgår en isoterm transformation, er dens tryk omvendt proportionalt med det besatte volumen. Fra denne lov får vi det hvordan TO = T Vi skal:
POVO = pV
Charles 'lov
Charles 'lov er loven, der styrer transformationer af en perfekt gas til konstant volumen. Disse transformationer kaldes isochoriske eller isometriske transformationer. Ifølge denne lov, når en perfekt gasmasse gennemgår en isokorisk transformation, er dens tryk direkte proportionalt med dets absolutte temperatur. Matematisk kan denne lov udtrykkes som følger:

hvor sO og TO er henholdsvis starttrykket og starttemperaturen.
Gay-Lussacs lov
Gay-Lussacs lov er loven, der styrer transformation af en perfekt gas ved konstant tryk. Denne lov, på trods af navnet Gay-Lussac, var allerede blevet opdaget af fysikeren og kemikeren A.C. Charles. Ifølge loven er gasens volumen, når en gas gennemgår en isobar transformation, direkte proportional med dens absolutte temperatur. Matematisk kan denne lov udtrykkes som følger:

Hvor VO og TO svarer henholdsvis til startvolumen og starttemperatur.
Af Marco Aurélio da Silva
Se mere!!
Gastransformationer
Ved hvad gastransformationer er.
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
SANTOS, Marco Aurélio da Silva. "Undersøgelse af gasser"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Adgang til 27. juni 2021.


