Kovalent binding opstår, når to atomer deler par elektroner for at erhverve elektronkonfigurationen af en ædelgas (med 8 elektroner i valensskallen eller med 2, i tilfælde af dem med kun K-skallen), i henhold til reglen om oktet.
Der er dog specielle tilfælde af kovalente bindinger, hvor det delte elektronpar kommer kun fra et af de atomer, der allerede er stabile. Tidligere blev denne type kovalent binding kaldt dativ, i dag kaldes det mere almindeligt koordinere.
Se nogle eksempler for at forstå, hvordan dette sker:
- CO (kulilte):
Kulstof har 4 elektroner i sin valensskal. Derfor skal den ifølge oktetreglen være stabil, skal den modtage 4 flere elektroner, i alt 8. Oxygen har derimod 6 elektroner i valensskallen og skal modtage 2 elektroner for at få konfigurationen af ædelgasneonet.
Så først deler kulstof og ilt to par elektroner, så ilt er stabilt:
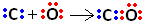
Kulstof forbliver imidlertid ustabilt, da det stadig har 6 elektroner og har brug for 2. Derfor deler ilt, som allerede er stabilt, et af dets elektronpar med kulstof, det vil sige, det danner en dativbinding med det, hvilket gør det stabilt:

Bemærk, at den koordinerede kovalente binding kan repræsenteres ved en bindestreg, ligesom den almindelige kovalente binding.
- KUN2 (Svovldioxid):
Hvert svovl- og iltatom har 6 elektroner i deres valensskaller, så de har brug for at modtage 2 elektroner hver. Oprindeligt danner svovl to almindelige kovalente bindinger, der deler to par elektroner med et af iltatomerne, begge forbliver stabile med 8 elektroner.
Stop ikke nu... Der er mere efter reklamen;)
Men det andet iltatom er ikke stabilt, så svovl deler et par af dets elektroner med det via en koordineret eller dativ kovalent binding:
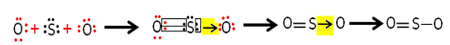
Bemærk, at i dette tilfælde har vi tre atomer i molekylet, så der kan være en migration af bindingen fra et atom til et andet. Svovldioxidmolekylet kan også repræsenteres således: O ─ S ═ O.
Vi kalder dette bindingsfænomen resonans. Se yderligere tre eksempler i nedenstående tabel:
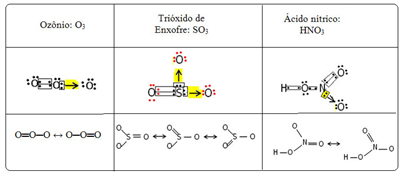
Mulige strukturer kaldes resonansstrukturer eller kanoniske former.
Denne type binding forekommer også i dannelsen af ioner, som i tilfældet med hydroniumioner (H.3O+) og ammonium (NH4+).
Først H-kationen+ det dannes, når brint mister sin enkeltelektron og efterlader det med en positiv ladning. Så det bliver nødvendigt at modtage to elektroner for at være stabile. Dette sker gennem en dativbinding med vand (i tilfælde af hydroniumionen) og med ammoniak (i tilfælde af ammoniumionen). Holde øje:

Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Dativ eller koordineret kovalent binding"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm. Adgang til 28. juni 2021.