I teksten "Koncentration i mol / l eller molaritet”Du så, at koncentrationen i mol / L vedrører mængden af stof i det opløste stof (n1, målt i mol) med opløsningens volumen i liter (V). Der er dog nogle opløste stoffer, der, når de placeres i vand, genererer ioner.
Et eksempel er, når vi lægger salt (NaCl) i vand, der sker en tiltrækning mellem den positive pol af vandet med Cl og den negative pol med Na, hvilket giver anledning til Na-ioner+ og Cl-.
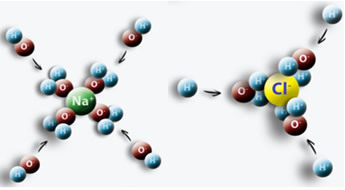
Det er vigtigt at vide, hvordan man bestemmer koncentrationen i mol / L af disse ioner, da dette kan være nyttigt i mange situationer. Et område, der bruger dette, er medicin, især i medicinske blodprøver. Vores blod og andre kropsvæsker har ioner opløst i sig. Hvis koncentrationen af disse ioner i vores blod er over eller under normal, kan det kompromittere vores krops funktion og føre til lidelser og sygdomme.
Se tilfældet med jernioner (Fe2+): hvis personen mangler denne ion, kan han udvikle anæmi. Når en person, der har anæmi, får at vide, at de har brug for at spise jernrige fødevarer eller endda noget medicin, der indeholder jern, er det faktisk jernionen og ikke det metalliske element.
Et andet tilfælde er, når der er tab af calciumioner (Ca2+) i knogler, der forårsager osteoporose, som vist på billederne med forstørrede billeder af knogler nedenfor:

Se på andre eksempler på ioner, der har vitale funktioner i vores krop og skal være i den korrekte koncentration:

I betragtning af disse oplysninger bliver det derfor tydeligt, at det er virkelig vigtigt at vide, hvordan man beregner koncentrationen af ioner i opløsninger. Men hvordan kan dette gøres?
Det er muligt at bestemme koncentrationerne i mol / L af de ioner, der er til stede i opløsninger, hvis der kendes to væsentlige data, som er:
- Formlerne af stoffer opløst i vand;
- Molariteten af dine løsninger.
Med disse data i hånden, skriv dissociations- eller ioniseringsligningen for det pågældende opløste stof og find ved deduktion koncentrationen af ioner som den er proportional med antallet af mol af hver ion. Dette betyder, at koncentrationen af ioner er proportional med deres respektive koefficienter i ioniserings- eller dissociationsligningen.
Stop ikke nu... Der er mere efter reklamen;)
Se følgende eksempel for bedre at forstå, hvordan denne beregning udføres:
"Overvej, at koncentrationen i mængden af stof af en given vandig opløsning af magnesiumphosphat (Mg3(STØV4)2 er 0,5 mol / l. Hvad vil koncentrationen i mol / L være af magnesiumkationer (Mg2+(her)) og fosfatanioner (PO3-4 (aq)) i denne løsning, i betragtning af at graden af dissociation (α) var 100%? "
Det første trin i løsning af dette problem er at skrive dissociations- eller ioniseringsligningen. Hvis du har problemer, kan du basere dig på nedenstående generiske ligning:
1 AxBy → x A+ y + y B-x
1 mol x mol y mol
Så i betragtning i dette eksempel har magnesiumfosfat fuldstændigt adskilt, vi har følgende ligning:
1 mg3(STØV4)2 (aq) → 3 mg2+(her) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
Vi kan se, at 1 mol Mg3(STØV4)2 giver 3 mol Mg2+(her) og 2 mol PO3-4 (aq); således vil antallet af mol af kationen være 3 gange antallet af mol af det phosphat, hvormed opløsningen blev fremstillet, og antallet af anioner vil være 2 gange.
Da opløsningen er 0,5 mol / l Mg3(STØV4)2 (aq) betyder dette, at 0,5 mol Mg blev opløst i 1 liter af det3(STØV4)2, hvilket gav anledning til 1,5 mol / l Mg2+(her) og 1,0 mol / l PO3-4 (aq):
1 mg3(STØV4)2 (aq) → 3 mg2+(her) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
0,5 mol x y
1. 0,5 3. 0,5 2. 0,5
0,5 mol / l 1,5 mol / l1,0 mol / l
Men hvad nu hvis graden af dissociation eller ionisering ikke var 100%? Lad os sige, at det var 70%, hvordan ville vi gå ud på at finde ud af mol / L-koncentrationen af disse ioner?
I så fald skal du bare udføre en simpel regel på tre. Se nedenunder:
1,5 mol / l Mg2+(her) 100 %
x 70%
x = 70. 1,5 → x = 1,05 mol / l Mg-ioner2+(her)
100
1,5 mol / l PO3-4 (aq) 100 %
y 70%
y = 70. 1,0 → y = 0,70 mol / L PO-ioner3-4 (aq)
100
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Ionkoncentration i mol / l"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm. Adgang til 28. juni 2021.
Kemi

Dissociation and Ionization, Italian Scientist Volta, Electric Current, Swedish Physical Chemist Svant August Arrhenius, Theory of Arrhenius, positive ioner, kationer, negative ioner, anioner, kaustisk soda, bordsalt, polære molekyler, dissociation ionisk,


