Æter det er en iltet organisk funktion, det vil sige, det har det kemiske element ilt ud over kulstof og brint. Denne funktion har som sin vigtigste strukturelle egenskab tilstedeværelsen af to organiske radikaler fastgjort til et iltatom.
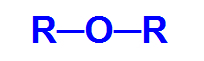
Generel strukturformel for en ether
Således er carbonets kæde i en ether heterogen og kan enten have to identiske eller forskellige radikaler alkyl, typer af radikaler, der ikke har en aromatisk struktur, eller aryl, radikaler, der ikke har en struktur aromatisk.
Fysiske egenskaber ved ether
Hvad angår den fysiske tilstand ved stuetemperatur: når æter den har fire eller flere kulstofatomer i sin sammensætning, den er flydende;
Hvad angår smeltepunkt og kogepunkt: sammenlignet med andre organiske masseforbindelser tilnærmelsesvis molær, har et smeltepunkt svarende til alkanernes og lavere end resten af forbindelserne økologisk;
Med hensyn til densitet: de er forbindelser, der har en lille densitet sammenlignet med vand;
Hvad angår interaktionskræfterne: Etherne er sammensat med lav polaritet, der interagerer med hinanden gennem en svag permanent dipolinteraktion. Med vand og alkoholer har ethere evnen til at interagere gennem hydrogenbindinger.
hvad angår polaritet: er forbindelser, der har vinkelgeometri, og derfor er de polære.
Hvad angår den organoleptiske egenskab: de er stoffer, der afgiver en meget behagelig lugt, men deres indånding kan forårsage afhængighed.
Officiel nomenklatur for etheren
Mindre stampræfiks + oxy + større stampræfiks + infix + o
At udføre den officielle nomenklatur for a æter, Det er afgørende at bestemme, hvilken der er din hovedligand, og hvilken der er din mindre ligand. For at gøre det skal du følge to eksempler på anvendelse af denne navngivningsregel nedenfor:
1. eksempel:
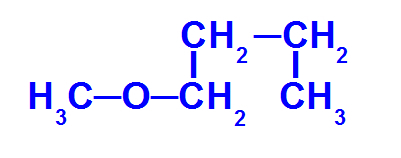
Strukturformel for en ether med færre kulhydrater
Etheren ovenfor har følgende radikaler:
Methyl (CH3-);
Butyl (CH3-CH2-CH2-CH2-).
For at navngive denne forbindelse har vi:
mindre radikal præfiks: Met
+
oxy
+
større stamme præfiks: men
+
en (fordi den kun har enkelte links)
+
O
Så navnet på dette æter det vil være methoxybutan.
2. eksempel:
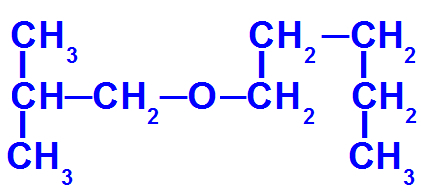
Strukturformel for en ether med flere carbonatomer
Denne ether har følgende radikaler:
Isobutyl [(CH3)2-CH-CH2-);
pentyl (CH3-CH2-CH2-CH2-CH2).
For at navngive det har vi derfor:
mindre radikalt præfiks: isobut
+
oxy
+
hovedstamme-præfiks: pent
+
en (fordi den kun har enkelte links)
+
O
Således navnet på æter det drejer sig om vil være isobutoxypentan.
Sædvanlig nomenklatur for ether
Ether + radikale navn (enkleste og derefter mest komplekse) + ico
eller
Radikale navne + ether
Følg nedenstående to eksempler på anvendelse af denne navngivningsregel:
1. eksempel:

Strukturformel for en ether, der har fire carbonatomer
At æter præsenterer følgende radikaler:
Methyl (CH3);
Isopropyl (CH3-CH-CH3).
Så for denne forbindelse har vi:
Æter
+
mindre radikal: methyl
+
større radikale præfiks: isopropyl
+
deres
Således navnet på æter det drejer sig om vil være methylisopropylether eller ellers methylisopropylether.
2. eksempel:

Strukturformel for en ether, der har fem carbonatomer
Etheren ovenfor har følgende radikaler:
Ethyl (CH3-CH2-);
Propyl (CH3-CH2-CH2-).
For at navngive denne forbindelse har vi:
Æter
+
mindre radikal: ethyl
+
større radikale præfiks: propyl
+
deres
Således navnet på æter det drejer sig om vil være ethylpropylether, som også kan være ethylpropylether.
Anvendelse af ethere
Generelt anvendes etere:
Som inerte organiske opløsningsmidler, dvs. ikke deltage i nogen reaktion;
Anvendes til udvinding af essenser, såsom blomster, træ osv .;
Anvendes til ekstraktion af forskellige olier og fedtstoffer.
Af mig. Diogo Lopes
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eter.htm
