Vi er omgivet af udstyr, der for at kunne fungere har brug for celler eller batterier. Imidlertid bliver mange af disse bærbare enheder mindre og dermed kommer det store behov for miniaturebatterier.
Et eksempel på denne type batteri er kviksølv eller også kaldet kviksølv-zinkbunke.
Hver celle består af to elektroder, anoden (negativ pol) og katoden (positiv pol) og en elektrolyt. I tilfælde af kviksølvcelle er anode er dannet af en kapsel af metallisk zink (Zn(s)) Det er katode om kviksølvoxid II (HgO(s)). Både Zn og HgO formales til pulver og komprimeres for at gøre bunken så lille som muligt. O elektrolyt er lavet af en løsning af mættet kaliumhydroxid (KOH(her)).
Zn oxiderer ved at donere sine elektroner til HgO som vist i semi-reaktionerne og den globale reaktion i denne celle nedenfor:
Anode-halvreaktion: Zn(s) + 2 OH1-(her) → ZnO(s) + 2 H2O(1) + 2e-
Katode-halvreaktion: HgO(s) + H2O(1) + 2e- → Hg(1) + 2 OH1-(Detq)
Global reaktion: HgO(s) + Zn(s) → ZnO(s) + Hg(1)
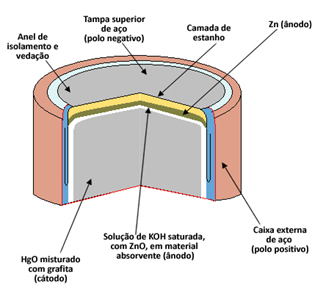
Kviksølvceller bruges i digitale ure, armbåndsure, kameraer, regnemaskiner, elektroniske arrangører, høreapparater og andre bærbare elektriske apparater, der kræver effektivt arbejde og holdbarhed, da disse batterier har spænding af 1,35V.

Desværre kan forkert bortskaffelse af disse batterier medføre alvorlige risici for miljøet, da de indeholder kviksølv, som er et tungmetal. Kviksølv kan forurene jord, grundvand, sø- og flodvand og nå ud til dyr og mennesker. Det er giftigt selv i små mængder. Blandt de sundhedsmæssige problemer, som kviksølv kan forårsage, er: skade på slimhinderne, huden, nyrerne, voldsom kvalme, opkastning, mavesmerter, blodig diarré, og det kan føre til døden.
For at finde ud af mere om, hvorfor batterier er giftigt affald, hvordan kviksølv er forurenet, og hvad vi skal gøre med brugte batterier, skal du læse teksterne nedenfor.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/pilhas-mercurio.htm