O beregning af atommasse af et element er den matematiske ressource, der bruges til at bestemme masseværdien til stede i det periodiske system for hvert af de eksisterende kemiske grundstoffer. Generelt at udføre atommasseberegning, skal vi kende følgende variabler af kemisk element:
Elementisotoper;
Massetal for hver isotop af elementet;
Procentdel af hver isotop af elementet i naturen.
Beregningen af atommassen af brint blev for eksempel udført på baggrund af følgende data:
Præsenterer protiumisotoperne (H1), deuterium (H2) og tritium (H3);
Masserne af disse isotoper er henholdsvis 1, 2 og 3;
Procentdelen af Protium i naturen er 98,9%;
Procentdelen af deuterium i naturen er 0,09%;
Procentdelen af tritium i naturen er 0,01%.
Matematisk standard til beregning af atommasse
At udføre atommasseberegning af ethvert kemisk element, skal vi bruge følgende matematiske mønster:
1O: multiplicere massetallet for hver isotop med dens procentdel;
2O: tilføj alle de resultater, der blev fundet i det første trin multiplikationer;
3O: divider den fundne sum med 100.
M.A. = massenummer. procent + massenummer. procentdel
100
Mind Map: Atomic Mass
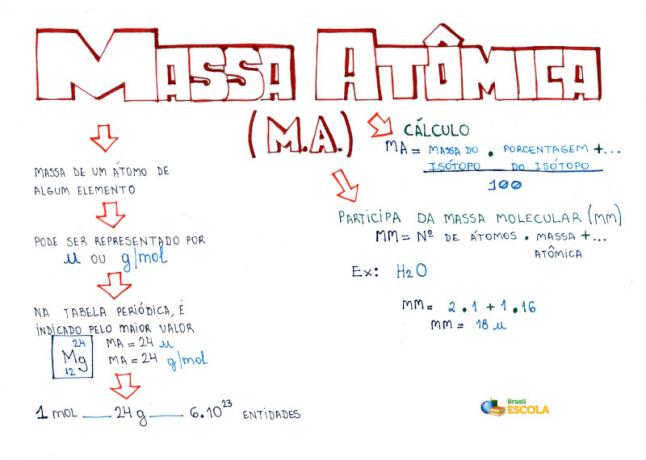
* For at downloade tankekortet i PDF, Klik her!
Eksempler på atommasseberegning
⇒ 1. eksempel: Beregning af svovlens atommasse.
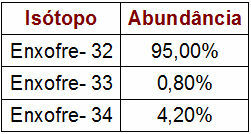
Procentdel og massedata for svovlisotoper
Tabellen angiver massetallet og procentdelen af hver svovlisotop i naturen. For at udføre atommasseberegningen skal du blot udføre følgende trin:
1O Trin: gang massetallet for hver isotop med værdien af dens overflod.
Svovl - 32 (S32)
s32 = 32.95
s32 = 3040
Svovl - 33 (S33)
s33 = 33.0,8
s33 = 26,4
Svovl - 34 (S34)
s34 = 34.4,2
s34 = 142,8
2O Trin: tilføj de værdier, der findes i multiplikationerne af massetallet og isotopens overflod.
Sum = S32 + S33 + S34
Sum = 3040 + 26,4 + 142,8
Sum = 3209,2
3O Trin: beregne atommassen ved at dividere summen af resultaterne fundet med 100:
M.A. = Sum
100
M.A. = 3209,2
100
M.A. = 32,092 u
⇒ 2. eksempel: Et givet kemisk element (D) har tre isotoper, hvis massetal er:
30D 32D 34D
At vide, at atommassen for dette element er 32,20 u, og at der er 20% af isotopen 32D i naturen, hvad er værdien af procenterne for de andre isotoper?
Erklæringen giver massetallene, atommassen og procentdelen af en af isotoperne. For at bestemme procentdelen af andre isotoper skal vi udføre følgende trin:
1O Trin: bestemme procentdelen af hver isotop.
Isotop - 30 (DS30)
DS30 = 30.x
DS30 = 30x
Isotop - 32 (DS32)
DS32 = 32.20
DS32 = 640
Isotop - 34 (D34)
DS34 = 34.y
DS34 = 34 år
2O Trin: bruge alle de data, der findes i det matematiske udtryk til at beregne atommassen.
M.A. = massenummer. procent + massenummer. procentdel
100
32,2 = 30x + 640 + 34y
100
32,2.100 = 30x + 640 + 34y
100
3220 - 640 = 30x + 34y
30x + 34y = 2580
x = 2580 - 34 år
30
3O Trin: Brug det ovenfor angivne udtryk fra følgende ræsonnement:
Procent af isotop 1 + Procent af isotop 2 + Procent af isotop 3 = 100%
x + 20 + y = 100
x + y = 100 - 20
x + y = 80
x = 80 - y
2580 - 34 år = 80-y
30
2580 - 34 år = 30. (80-y)
2580-34 å = 2400 - 30 år
2580 - 2400 = 34 år-30 år
4y = 180
y = 80
4
y = 45%
4O Trin: beregne procentværdien af x i udtrykket konstrueret i det tredje trin.
x + y = 80
x + 45 = 80
x = 80 - 45
x = 35%
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/calculo-massa-atomica.htm
