Saltsyre er et hydracid med højt ioniseringspotentiale, det er en gullig væske, meget ætsende og giftig. Det bruges i forskellige industrielle processer, såsom fremstilling af rengøringsprodukter og farmaceutiske hydrochlorider, i fødevarer og i stålfremstillingsprocesser.
Det er også til stede i den menneskelige organisme; O mavesaft som virker i fordøjelsen af proteiner er en syreopløsning; saltsyre og andre stoffer, såsom enzymer og salte. Eksponering, indånding eller indtagelse af Koncentreret saltsyre er meget sundhedsskadeligt, som endda kan forårsage død.
Læs også: Svovlsyre - stof med høj ætsende effekt
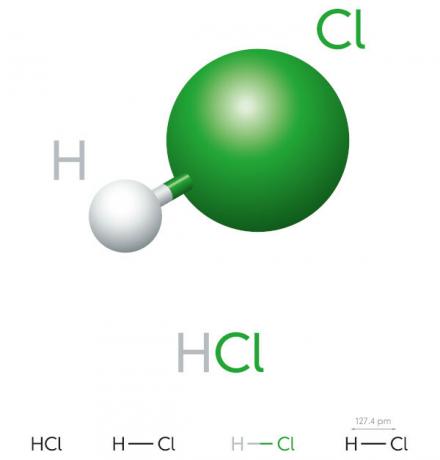
Saltsyreegenskaber
- uorganisk forbindelse
- stærk syre
- Højt ioniseringspotentiale
- Væske
- gulligt udseende
- Giftig
- Ætsende
- Flygtige
- Hygroskopisk (har tendens til at absorbere ávand af miljøet)
- Opløselig i vand
Stop ikke nu... Der er mere efter reklamen;)
Saltsyreproduktion
Saltsyren var opdaget af en muslimsk alkymist kaldet Jabir Ibne Haiane, også kendt som Gaber og betragtes som far til arabisk kemi. Han syntetiserede stoffet baseret på en
reaktion mellem havsalt (NaCl) og svovlsyre (På2KUN4).2NaCl + H2KUN4 → I2KUN4 + 2HCl
I øjeblikket saltsyre produceres i stor skala gennem elektroniskólysis natriumchlorid i vandig opløsning. Fra denne proces opnås gas klor (Cl2), gas hydrogen (H2) og natriumhydroxid (NaOH). Klor- og brintgasser reagerer for at danne saltsyre:
Cl2 + H2 → 2HCl
Imidlertid, denne reaktion er ekstremt eksoterm og meget farlig. I øjeblikket er det meste af den saltsyre, der produceres industrielt, forbundet med produktionen af organiske forbindelser, hvilket er en mere økonomisk og sikrere proces.
R-H + Cl2 → R-Cl + HCI
(Betragt R som et organisk radikal.)
Se også: Tips til at bestemme-hvis styrken af syrer

Saltsyre påføring
- Metal bejdsning: Saltsyre bruges til at "rense" metaller, før de behandles, fjerne rust, kalk og andre urenheder fra overfladen.
- Produktion af organiske forbindelser: saltsyre anvendes som et reagens til opnåelse af vinylchlorid, som anvendes til fremstilling af plast. Saltsyre kommer også fra chloropren, som bruges i syntetiske gummier.
- Produktion af uorganiske forbindelser: saltsyre er til stede i flere industrielle processer til fremstilling af reagenser og forbindelser Uorganiske produkter, blandt dem er produkter til vandbehandling, såsom jern (III) chlorid og jern (III) chlorid. aluminium.
- Anvendes som rengøringsmiddel: Saltsyre anvendes også til post-konstruktion, husholdnings- og kemisk rengøring af værktøj og maskiner.
- Fødevareforarbejdning: Saltsyre anvendes i forskellige reaktioner til produktion af mad og tilsætningsstoffer, såsom hydrolyse af stivelse og proteiner, eller i slutproduktet til pH-balance.
- Narkotikaproduktion: Saltsyre anvendes til fremstilling af opløselige saltsyrer, der er til stede i flere lægemidler, såsom doxycyclinhydrochlorid, der anvendes til behandling af tyfus og kopper.
Saltsyre i kroppen
Saltsyre er til stede i vores fordøjelsessystemet, gastrisk juice produceret af vores mave er en opløsning af vand, enzymer, saltsyre, uorganiske salte og en lille procentdel af mælkesyre.
O madkage omdannes til chyme, en sur masse (takket være gastrisk juice og dens sure sammensætning), er dette når fordøjelse af proteiner, forvandlet til polypeptider og aminosyrer der vil blive absorberet af kroppen.
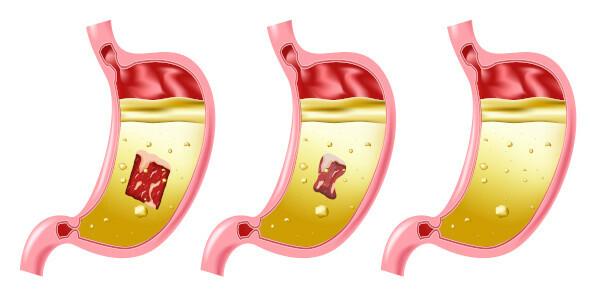
Saltsyrefare
Saltsyre er en meget stærk og ætsende syre, så kontakt med stoffet forårsager flere skader:
- Hud: Forårsager forbrændinger og irritation.
- Øjne: Forårsager alvorlig irritation og kan forårsage blindhed.
- Indånding: Forårsager irritation og skade på de øvre luftveje.
- indtagelse: forårsager korrosion i det orale system, og i mave-tarmkanalen kan det forårsage opkastning, blødning, diarré, cirkulationsproblemer, som kan føre til døden.
- Eksponeringfortsættes: angriber slimhindeområder først og forårsager dermatitis og konjunktivitis, blødende tandkød, fotosensibilisering; hyppig indånding, selv i lav koncentration af forbindelsen, kan forårsage gastritis og næseblod.
Også adgang: Eddikesyreegenskaber og egenskaber

løste øvelser
Spørgsmål 1 - (Udesc) Med hensyn til saltsyre kan det siges, at:
A) når det er i vandig opløsning, tillader det passage af elektrisk strøm.
B) er en syre.
C) er en svag syre.
D) har en lav grad af ionisering.
E) er et ionisk stof.
Løsning
Alternativ A. Saltsyre er ikke en syre, da den kun har en ioniserbar H, men en stærk syre, molekylært stof med højt ioniseringspotentiale. DET ionisering i et vandigt medium fremmer ledningen af elektrisk strøm på grund af eksistensen af frie ioner.
Spørgsmål 2 - I en opløsning af saltsyre og vand kan vi sige, at forekomsten af molekylært hydrogenchlorid (HCl) er minimal, det er fordi
A) saltsyre i kontakt med vand fortyndes.
B) hydrogenchlorid er et stof, der ikke opløses i vand.
C) hydrogenchlorid har et højt ioniseringspotentiale, når HCI-molekylet i et vandigt medium danner H-ioner+ Cl-.
D) saltsyre, da den er meget flygtig, adskiller sig fra opløsningen og efterlader kun vandmolekyler.
E) saltsyre er et ionisk stof, derfor dissocieres det i vandig opløsning og danner ioner.
Løsning
Alternativ C.
A) Svaret stemmer ikke overens med spørgsmålet. Fortynding af saltsyre i vand retfærdiggør ikke fraværet af molekylær HCI.
B) Forkert, hydrogenchlorid er opløseligt og har en affinitet for vand.
C) Korrekt
D) Selvom saltsyre er flygtig, forekommer denne adskillelse af de to arter i opløsningen ikke signifikant.
E) Saltsyre er en opløsning af hydrogenchlorid og vand, hvor hydrogenchlorid er et ikke-ionisk molekylært stof.
Af Laysa Bernardes Marques de Araujo
Kemi lærer
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
ARAúJO, Laysa Bernardes Marques de. "Saltsyre"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Adgang til 27. juni 2021.