Elektrolýza je proces široce používaný chemickým průmyslem, protože umožňuje jeho získání látky, které v přírodě neexistují volně, jako je například chlor, jod, hydroxid sodný ostatní.
Elektrolýza je opakem buňky, ve které se elektřina získává redoxními reakcemi, tj. Chemická energie se transformuje na elektrickou energii. Již v elektrolýze se elektřina používá k výrobě redoxních reakcí a chemické energie.
Odtud tedy původ jeho názvu elektro znamená "elektrický proud" a lýza znamená „zlomit“. Přesně to se děje, elektrický proud rozbije nebo rozloží látku, které je vystaven.
Baterie je spontánní proces, elektrolýza však je to ne spontánní proces, který je třeba spustit pomocí elektrického proudu.
Existují dva typy elektrolýzy: a ohnivý a ve vodném médiu. V tomto textu se budeme zabývat prvním případem.
Rozdíl mezi magnétovou elektrolýzou a elektrolýzou ve vodném prostředí je forma, ve které je látka, která bude vystavena elektrickému proudu. V případě magnétové elektrolýzy je iontová látka v kapalném stavu, tj. Roztavená, bez přítomnosti vody.
Slovo „ohnivý“ pochází z latiny ohnivý, což znamená „hořící, zanícené“.Při elektrolýze se používá nádoba, která se nazývá a Kuba nebo elektrolytický článek, kde jsou namontovány dvě elektrody, kterými bude procházet elektrický proud. Elektrody mohou být inertní (neměňte během elektrolýzy) nebo aktivní (Během elektrolýzy trpí nějakou změnou). Nejpoužívanější jsou platinová nebo grafitová plniva.
Elektrody jsou poté připojeny ke zdroji stejnosměrného proudu (článek nebo baterie). Záporný pól baterie dodá elektrony jedné z elektrod, stane se záporně nabitým a přitáhne kationty (kladné ionty) z roztavené látky. Protože přitahuje kationty, tato záporná elektroda se nazývá katoda. V něm kationy přijímají elektrony a redukují se.
Kladná elektroda přitahuje anionty (záporné ionty) a díky tomu se jí říká anoda. Aniony vypouštějí své elektrony na anodě a podstupují oxidaci.
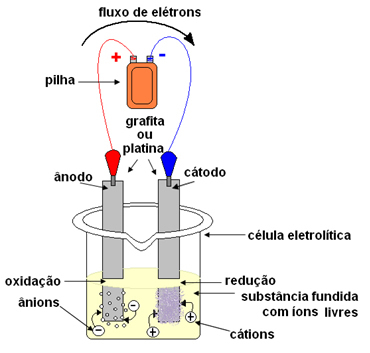
U baterií se kladná elektroda nazývá katoda a záporná anoda. Tady v elektrolýze je to naopak, anoda je kladný pól a katoda je záporný pól. V obou případech však v baterii a v elektrolýze dochází na anodě k oxidaci a na katodě k redukci.
Stručně, máme:

Dalším důležitým faktem je, že článek nebo baterie použitá k výrobě elektrického proudu musí mít ddp (potenciální rozdíl) rovný nebo větší než rozdíl reakčního potenciálu.
Chcete-li lépe porozumět tomu, jak probíhá proces elektrolýzy a jak rozkládá látky produkující důležité prvky nebo jednoduché látky, přečtěte si text Elektrolýza vyvřelého chloridu sodného.
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea.htm

