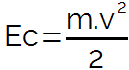Molalita je to forma koncentrace řešení (jako společné soustředění, koncentrace v mol / l, hromadný název), který se používá k určení vztahu mezi množstvím v solutu v dané hmotnosti rozpouštědla.
Symbol použitý k označení molalita je W; Ó krtko číslo rozpuštěné látky představuje n1; a hmotnost rozpouštědla je symbolizována m2. S těmito symboly tedy můžeme sestavit matematický výraz pomocí navrhované definice molality:
W = Ne1
m2
Tento vztah je matematicky vyjádřen dělením, tedy molalita je forma koncentrace, která zahrnuje dělení počtu molů rozpuštěné látky hmotou rozpouštědla.
Je pozoruhodné, že počet molů rozpuštěné látky má specifické matematické vyjádření, protože jde o vztah mezi hmotností rozpuštěné látky (m1), obsažené v roztoku, a molární hmotnost této rozpuštěné látky (M.1):
Ne1 = m1
M1
Z toho tedy můžeme spojit vzorec pro počet molů rozpuštěné látky se vzorcem pro molalita, což má za následek následující výraz:
W = m1
M1.m2
Bez ohledu na použitý vzorec, ať už je spojen se vzorcem molárního čísla nebo ne, použitá měrná jednotka musí být mol / Kg nebo molal. Je tedy důležité sledovat data pomocí následujících jednotek:
Hmota rozpuštěné látky (m1): gramy (g)
Molární hmotnost rozpuštěné látky (M1): gramy na mol (g / mol)
Počet molů rozpuštěné látky (n1): mol
Hmotnost rozpouštědla (m2): kilogram (kg).
Níže uvádíme několik příkladů cvičení na webu molalita:
1. příklad - (ITA-SP) Štítek na lahvičce uvádí, že obsahuje 1,50 molal LiNO roztoku3 v ethanolu. To znamená, že řešení obsahuje:
a) 1,50 mol LiNO3/ kilogram roztoku.
b) 1,50 mol LiNO3/ litr roztoku.
c) 1,50 mol LiNO3/ kilogram ethanolu.
d) 1,50 mol LiNO3/ litr ethanolu.
e) 1,50 mol LiNO3/ mol ethanolu.
V tomto cvičení bychom měli provádět pouze teoretickou analýzu, protože uvádí molalitu (1,5 molal LiNO3 v ethanolu) a požádá o složení roztoku. Víme, že molalita je vztah mezi molárním číslem rozpuštěné látky (LiNO3) a hmotnost rozpouštědla (ethanol), a že výraz molal může být nahrazen mol / kg. Proto to máme v řešení (alternativa c):
Nepřestávejte... Po reklamě je toho víc;)
1,5 mol LiNO3;
1 kg ethanolu.
2. příklad - (UFF-RJ-adaptovaný) Glukóza, strukturního vzorce C6H12Ó6, je jednoduchý cukr a je také hlavním zdrojem energie pro člověka a další obratlovce. Složitější cukry lze převést na glukózu. V sérii reakcí se glukóza spojuje s kyslíkem, který dýcháme, a produkuje po mnoha meziproduktech oxid uhličitý a vodu s uvolňováním energie. Nemocniční intravenózní výživa obvykle sestává z roztoku glukózy ve vodě s přídavkem minerálních solí. Za předpokladu, že 1,50 g glukózy je rozpuštěno v 64,0 g vody, jaká bude molalita výsledného roztoku?
a) 0,13
b) 0,20
c) 0,40
d) 0,31
e) 0,41
Údaje poskytnuté cvičením jsou:
Hmota rozpuštěné látky (m1): 1,5 g
Hmotnost rozpouštědla (m2): 64 g
Molekulární vzorec rozpuštěné látky: C6H12Ó6
Chcete-li určit molalitu roztoku, je zajímavé provést následující kroky:
1. krok: Transformujte hmotu rozpouštědla z g na kg.
K tomu stačí vydělit dodanou hmotnost 64 g na 1000, což má za následek 0,064 kg.
2. krok: Určete molární hmotnost rozpuštěné látky.
K tomu musíme vynásobit počet atomů prvku v molekulárním vzorci jeho atomovou hmotou (přítomnou v periodické tabulce) a poté přidat výsledky:
M1 = 6. hmotnost C + 12. hmotnost H + 6. hmotnost O
M1= 6.12 + 12.1 + 6.16
M1 = 72 + 12 + 96
M1 = 180 g / mol
3. krok: Poskytnutá data a nalezená v předchozích krocích použijte v následujícím výrazu:
W = m1
M1.m2
W = 1,5
180.0,064
W = 1,5
11,52
W = 0,13 mol (přibližně)
Podle mě. Diogo Lopes Dias