THE solný most navrhl anglický chemik Frederic Daniell v roce 1836, kdy tento vědec zřídil baterie pojmenované po něm (Danillova hromada). tento most je trubka ve tvaru U, která má dva porézní konce. (sestávající z bavlny nebo agaru-agaru) a obsahuje vodný roztok tvořený vodou a solí. Nepřímo spojuje roztoky dvou polovičních článků článku (anoda a katoda).
Pozorování: Anoda je záporný pól baterie a je tam, kde dochází k oxidaci, a katoda je kladný pól a kde dochází k redukci.
Abychom pochopili důležitost solného mostu, je zpočátku nutné porozumět fungování hromady. Viz následující diagram:
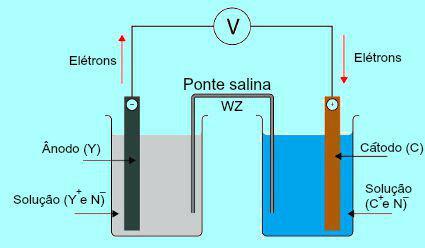
Obecné schéma Daniell stacku
Zpočátku kov (Y) desky přítomné v anodě prochází oxidací. Při oxidaci se kov změní na kation, který spadne do roztoku, ve kterém je deska. Z tohoto důvodu začíná anodový roztok vykazovat vyšší koncentraci kationtů (Y+). V tomto případě je pozorován pokles anodové kovové desky.
Y → a- + Y+
Poté elektrony ztracené během oxidace kovu anodové desky procházejí vnějším elektrickým drátem a jdou na kovovou desku přítomnou v katodě. Deska přítomná na katodě se tedy nabije elektrony.
-
Tyto kationty (C+) v roztoku se pohybujte směrem ke katodové desce, protože je nabitá elektrony. Když kationy získají elektrony přítomné v desce, stanou se neutrálními (stabilními a pevnými) a přilnou k nim. Z tohoto důvodu představuje katodový roztok vyšší koncentraci aniontů než kationtů. V tomto případě je pozorováno zvětšení velikosti katodové kovové desky.
Nepřestávejte... Po reklamě je toho víc;)
C+ + a- → C.
Z pochopení toho, jak Daniellina hromadaje možné pozorovat, že roztok přítomný v anodě přijímá větší množství Y kationtů+ v důsledku oxidace kovu desky X. Roztok přítomný v katodě na druhé straně ztrácí své kationty (C+), protože trpí snížením plaku.
Právě v této otázce je vyzdvižena práce solného mostu. Hlavní funkcí tohoto můstku je podporovat rovnováhu nábojů přítomných v anodovém i katodovém roztoku. V solném můstku máme vždy sůl (obvykle chlorid draselný nebo dusičnan amonný.) Disociovaný ve vodě. Podívejte se na znázornění rovnice v solném můstku:
WZ + H2O → W+ + Z-
V solném můstku jsou dva ionty (W+ a Z.-), které jsou posunuty ke katodě a anodě podle:
The) Anoda přijímá anionty (Z-) přítomný v solném můstku v důsledku oxidace prvku (Y), což způsobuje zvýšení množství kationtů (Y+) v řešení.
B) Katoda přijímá kationty (W+) solného můstku, protože během provozu na baterii byl kation (C+) přítomný v roztoku je na desce omezen. Katodový roztok má tedy větší množství aniontů (N.-), a proto přijímá kation přítomný v solném můstku.
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. "Plachtový most"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Zpřístupněno 28. června 2021.

