K hydrogenaci dochází u nenasycených acyklických uhlovodíků, tj., Které mají otevřené řetězce s dvojnými nebo trojnými vazbami, jako jsou alkeny, alkyny a dieny. Může se také vyskytovat v aromatických uhlovodících, protože mají dvojné vazby v kruhu, a v cyklech (cykloalkanech) až s pěti uhlíky.
Tyto sloučeniny reagují jako plynný vodík v přítomnosti nějakého katalyzátoru, jako je nikl, platina a palladium, za zahřívání. Dochází tedy k adiční reakci, při které je vazba pi (π) přerušena, čímž vzniknou dvě nové jednoduché vazby a do molekuly je zaveden vodík.
Obecně máme:
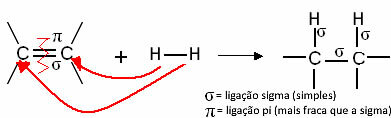
Obecná hydrogenační reakce
Nyní se podívejme na několik příkladů:
- Hydrogenace na alkeny: Získaným produktem je alkan.
Níže máme hydrogenační reakci ethylenu (nebo ethylenu) za účelem získání etanu:
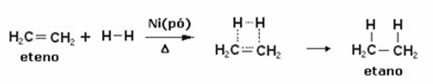
Příklad hydrogenační reakce ethylenu
Tento typ katalytické hydrogenace se používá v potravinářském průmyslu k výrobě polotuhých tuků, jako jsou margaríny. Rostlinné oleje a tuky se liší pouze v tom, že oleje mají dlouhé molekuly s dvojnými vazbami mezi uhlíky, zatímco tuky mají mezi nimi pouze jednoduché vazby uhlíky.
K přeměně oleje na tuk tedy stačí hydrogenovat olej. Tímto způsobem budou vaše dvojné vazby rozbity a převedeny na jednoduché vazby. Výsledkem je výroba hovorů hydrogenované rostlinné tuky.
- Alkyně hydrogenace: Vzhledem k tomu, že alkiny mají dvě vazby pí, probíhá jejich úplná hydrogenace ve dvou fázích, v první se vytvoří alken a ve druhé v alkanu.
V níže uvedené reakci dochází k hydrogenaci propinu s konečnou tvorbou propanu:
1. krok: H3C C ≡ CH + H2 → H3C CH═ CH2
2. etapa: H3C CH═ CH2 + 2 hodiny2 → H3C CH2─ CH3
Pokud chceme, aby se tato reakce zastavila v 1. kroku, musíme použít nějakou látku, která přeruší působení katalyzátoru.
- Hydrogenace dienů: Existují tři typy dienů: nahromaděné (dvojné vazby se objeví níže), izolovaný (dvojné vazby jsou odděleny nejméně dvěma jednoduchými vazbami) a konjugáty (dvojité vazby se objevují střídavě).
K hydrogenaci nahromaděných a izolovaných dienů dochází stejným způsobem, jaký jsme viděli u alkenů, ale dvojnásobně, protože dieny mají více nenasycenosti. Viz dva příklady:
* Příklad hydrogenace v akumulovaném dienu:
H H H
│ │ │
H3C CH ═ C ═ CH CH3 + 2 hodiny2 → H3C CH ─ C ─ CH CH3
│ │ │
H H H
* Příklad hydrogenace v izolovaném dienu:
H H H H
│ │ │ │
H3C CH ═ CH─CH2 CH ═ CH CH3 +2 hodiny2 → H3C CH ─ CH─CH2 CH ─ CH CH3
Na druhou stranu k hydrogenaci konjugovaných dienů může dojít dvěma způsoby: s přídavkem 1,2 a přídavkem 1,4. Nejběžnější je přídavek 1,2, ve kterém se vodíky přidávají k uhlíkům, které vytvářejí dvojnou vazbu, a při nízkých teplotách. Přidání 1,4 se naproti tomu vyskytuje při zvýšených teplotách a je to v případě rezonance a výskytu volných valencí v uhlících 1 a 4. Podívejte se na příklady jednotlivých případů:
* Příklad přidání 1,2 v konjugovaných dienech:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ─ C ─ CH ═ CH2
│ │
H H
* Příklad přidání 1,4 v konjugovaných dienech:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ═ CH CH2
│ │
H H
- Hydrogenace aromátů: Pi vazby benzenového kruhu jsou rozbité a atomy vodíku jsou přidány k uhlíkům, které tyto vazby tvoří.
Tento typ celkové hydrogenace je uveden níže:

Celková hydrogenační reakce benzenu
- Cyklická hydrogenace: Nastává tvorba alkanu.
Příklad: Hydrogenace cyklopropanu:
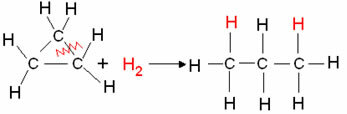
Hydrogenační reakce cyklopropanu
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm