Enzymy jsou biologické katalyzátory odpovědné za zvýšení rychlosti dané chemické reakce. Enzymy jsou obvykle bílkoviny, ale jsou tu nějaké ribonukleové kyseliny které působí jako enzymy a nazývají se ribozymy.
Aby se reakce urychlila, musí se enzymy vázat na činidla, která jsou známá jako substráty. Po dlouhou dobu se předpokládalo, že k tomuto odkazu dochází velmi rigidním způsobem, což je vzor známý jako zámek kláves. momentálně, Nicméně, je akceptován model známý jako indukované přizpůsobení., který předpokládá, že při vstupu substrátu do aktivního místa dochází k mírným změnám ve formě enzymu.
Přečtěte si také: Co je to metabolismus?
Co jsou to enzymy?
Enzymy jsou biomolekuly, které fungují jako katalyzátory, to znamená, že jsou látky schopné zrychlit rychlost chemické reakce které se vyskytují u živých bytostí, aniž by byly během těchto reakcí pohlceny. Bez působení enzymů by některé reakce byly velmi pomalé, což by poškodilo metabolismus. Enzymy selektivně urychlují reakce, a proto jsou velmi specifickými katalyzátory.
Enzymy jsou schopné urychlit reakci snížením aktivační energie, to znamená, že snižují množství energie, které musí být přidáno, aby mohla reakce začít.
[publikace_omnia]
Je každý enzym protein?
Ačkoli jsou často definovány jako biologické katalyzátory proteinové povahy, ne každý enzym je protein. Existují některé RNA, které fungují jako enzymy a nazývají se ribozymy. Většina enzymů jsou však bílkoviny, které tedy tvoří aminokyseliny. Aminokyselinové složení těchto biomolekul definuje trojrozměrnou strukturu, kterou získá.
Přečtěte si také: Jak fungují katalyzátorové látky?
Komplex enzym-substrát
Nazývá se reagenční substrát, na který působí enzym. Když se enzym váže na svůj substrát, tvoří se komplex enzym-substrát. Tato vazba probíhá v konkrétní oblasti, která se nazývá aktivní web.
Když mluvíme o enzymech na bázi bílkovin, aktivní místo odpovídá jen několika aminokyselinám, přičemž zbytek molekuly je zodpovědný za určení konfigurace aktivního místa. Tvar aktivního místa i tvar substrátu souvisí se specifičností enzymu, protože musí být komplementární.
Model zámku
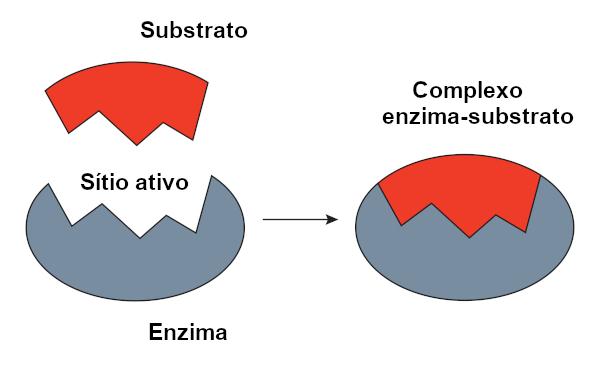
Ó model zámku, který navrhl Emil Fischer, je široce používán k vysvětlení interakce mezi enzymem a substrátem. Podle tohoto modelu existuje tuhá komplementarita mezi enzymem a substrátem, stejně jako klíč a zámek. Aktivní místo enzymu by mělo doplňkový tvar k substrátu, který by dokonale zapadl. Jiné molekuly by proto neměly přístup na toto místo, což by zaručovalo specificitu enzymu. Stejně jako klíč otevírá pouze zámek, enzym by se vážil pouze na substrát. Dnes však víme, že tohle model není správný, protože enzymy nejsou tuhé struktury, jak se dříve myslelo.
Model s indukovaným kováním
V současné době nejuznávanější model vysvětlující souvislost mezi enzymem a jeho substrátem je jedním z prasknout indukovaný, původně navržený Koshlandem a kol. Aktivní místo a substrát nefungují pevně jako klíč a zámek. Výzkum ukazuje, že jakmile substrát vstupuje do aktivního místa, enzym prochází mírnou modifikací, která upřednostňuje přizpůsobení mezi aktivním místem a substrátem. Abychom lépe porozuměli tomuto modelu, můžeme si představit interakci enzymu a substrátu jako potřesení rukou, které se po prvním kontaktu zpevní.
Kofaktory
Většina enzymů potřebuje k provádění svého katalytického působení pomocné molekuly, které se nazývají kofaktory. Kofaktory mohou být trvale připojeny k enzymu nebo mohou být slabě a reverzibilně připojeny k substrátu. Také mohou být anorganické nebo organické. Když jsou kofaktory organické molekuly, jsou nazývány koenzymy.
Nějaký vitamíny působí jako koenzymy, což je případ například riboflavinu, známého také jako vitamin B2. Jako příklady anorganických kofaktorů můžeme uvést železo a zinek v iontové formě.
Přečtěte si také: Vitamíny skupiny B - skupina vitamínů, které obecně fungují jako koenzymy
Klasifikace enzymů
Enzymy lze rozdělit na šest skupin, přičemž jako kritérium použili typ reakce, kterou katalyzují.
Oxidoreduktázy: enzymy související s reakcemi oxirsnížení.
Transferázy: katalyzují přenos skupin z jedné sloučeniny na druhou.
Hydrolázy: katalyzovat hydrolýzní reakce.
Liases: jedná přidáním skupin do dvojných vazeb nebo odstraněním skupin tvořících dvojnou vazbu.
Izomerázy: katalyzovat izomerační reakce.
Odkazy: enzymy, které způsobují degradaci molekuly ATP, využívající energii uvolněnou při této reakci k vytvoření nových sloučenin.
Faktory, které regulují aktivitu enzymů
Aktivita enzymu je ovlivněna faktory, hlavními jsou teplota a pH. Teplota obecně hraje pozitivní roli v chemických reakcích, což zvyšuje rychlost enzymatické reakce. Když však teplota zvyšuje nad optimální podmínky, reakční rychlost značně klesá. Je to proto, že je pozorována denaturace proteinů. Většina lidských enzymů má optimální teplotu mezi 35 a 40 ° C. Kromě teploty, pH ovlivňuje také enzymatickou aktivitu a je zde také optimální hodnota. Pro většinu enzymů je optimální hodnota pH v rozmezí 6 až 8.
Autor: Vanessa Sardinha dos Santos
Učitel biologie

