Drtivá většina materiálů nalezených v přírodě, v naší společnosti a v našich tělech nejsou čisté látky, ale ve skutečnosti směsi ze dvou nebo více látky.
I když většinu času označujeme minerální vodu pouze jako „vodu“, ve skutečnosti neobsahuje pouze čistou látku H2O, protože je výsledkem procesu, při kterém dešťová voda proniká do půdy a prochází různými horninami.
Jak již název napovídá, má kromě vody také několik rozpuštěných minerálů. Pokud jste zvědaví zkontrolovat štítek jakékoli minerální vody, uvidíte, že má ve svém složení chemie síranů strontnatých, vápníku, sodíku, draslíku, hydrogenuhličitanu sodného, fluoridu sodného ostatní.
Myšlenková mapa: Směsi
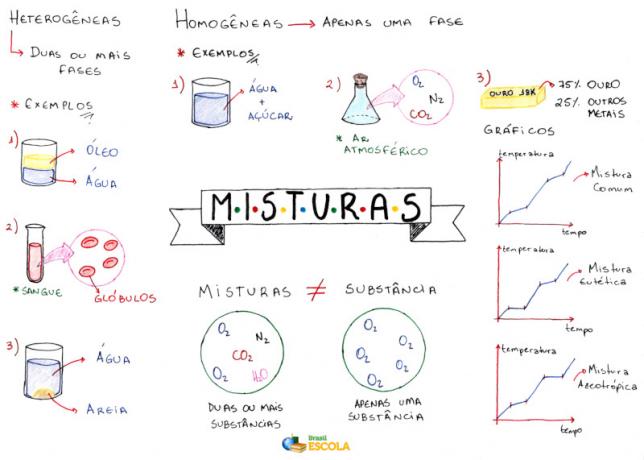
* Chcete-li stáhnout myšlenkovou mapu v PDF, Klikněte zde!
Jak je možné odlišit látku od směsi?
Níže uvedená destilovaná voda je čistá látka, která obsahuje pouze H2Ó:

Destilovaná voda používaná v laboratoři
Vizuálně to vypadá přesně jako směs vody a soli; lze je však odlišit od definice směsi. Dívej se:
→ Směsi jsou materiály, jejichž fyzikální vlastnosti nejsou konstantní, ale mění se při určité teplotě a tlaku.
Stačí tedy změřit fyzikální vlastnosti, jako jsou body tání a varu a hustota. Pokud jsou konstantní a dobře definované, je to a čistá látka (v případě destilované vody je její hustota při 4 ° C 1,0 g / cm3 a na hladině moře jsou body tání a varu 0 ° C, respektive 100 ° C).
Pokud jsou však předloženy varianty, jedná se o směs. Pokud zahřejete směs vody a soli, abyste zkontrolovali bod varu, uvidíte, že při změně z kapalného stavu na plynu, teplota nezůstává konstantní, jako u destilované vody, která zůstává na 100 ° C, dokud se veškerá kapalina nezmění parní.
Nyní jsou směsi že ani není nutné určovat jejich fyzikální vlastnosti, abychom věděli, že se jedná o směsi, stačí se podívat, jako je tomu v případě následující směsi vody a oleje:

Směs tvořená vodou a olejem
To naznačuje, že existují různé typy směsí, které lze klasifikovat homogenní a heterogenní. Podívejte se na každou z nich:
Homogenní směsi:
Jsou to ty, které mají jednotný vzhled s jednou fází (jednofázový). Příklady:
solný roztok (0,9 g chloridu sodného ve 100 ml vody);
solanka (36 g solí, jako je chlorid sodný, chlorid hořečnatý, jodičnan draselný, anti-zvlhčovadla a 100 ml vody);
hydratovaný alkohol (ethanol a voda);
vzduch (78% plynný dusík, 20% plynný kyslík, 2% jiné plyny a vodní pára);
ocel (kovová slitina tvořená 98,5% železa a 1,5% uhlíku).

Fyziologický roztok, ocel a formaldehyd, příklady homogenních směsí
Výše uvedené příklady to ukazují homogenní směsi mohou být v pevném, kapalném nebo plynném stavu. Tyto homogenní směsi se nazývají řešení a nelze je oddělit fyzikálními metodami, ale pouze chemickými technikami. Například k oddělení alkoholu od vody je nutné provést postup destilace, protože a odstředivka nebo filtrace to by nešlo.
Kromě toho je důležité zdůraznit, že musí být homogenní i při pohledu pod ultramikroskop. Pouhým okem se například mléko a krev mohou jevit jako homogenní, ale pod ultramikroskopem vidíme, že ve skutečnosti jsou heterogenní. Podívejte se na obraz krve pod ultramikroskopem a jeho jednotlivé fáze poté, co byla umístěna do ultracentrifugy:
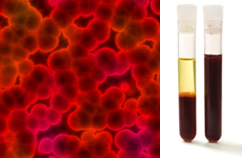
Mikroskopický obraz a krevní fáze
Heterogenní směsi:
Jsou ty, které mají více než jednu fázi. Příklady: voda a olej, voda a písek, led a voda, žula, voda a železo, nerozpuštěná sůl ve vodě atd.
Součásti heterogenní směsi objevují se ve většině případů v různých fyzikálních stavech a lze je oddělit fyzikálními metodami. Příkladem je, když připravujeme kávu a filtrujeme pevnou látku a oddělujeme ji od kapaliny.
Ale ne vždy se to stane, jak je ukázáno v případě oleje a vody, které se, i když jsou obě kapaliny, nerozpouštějí kvůli různým polarity jeho molekul.
Mentální mapa Matkou Victorem Ricardem Ferreirou
Učitel chemie
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/tipos-misturas.htm
