Představy o složení hmoty (atomu) se objevily ve starověkém Řecku kolem roku 450 př. N. L. a., převážně ze společností Democrito a Leucipo. Atom však ve skutečnosti získal vědecký charakter až po tzv Daltonova atomová teorie.
THE Daltonova atomová teorie bylo to zásadní pro rozvoj atomového poznání, protože sloužilo jako základ pro další vědce, aby poznali atom a jeho vlastnosti.
Kdo byl John Dalton?
Výcvikový chemik John Dalton se narodil v anglické Cumbrii v roce 1766 a zemřel v Manchesteru v roce 1844. Od raného věku byl jeho život předurčen k vědeckému výzkumu a výuce, a to natolik, že učil nebo přispíval k rozvoji různých oblastí poznání.
Jeho největším vědeckým dědictvím však byl vývoj první atomové teorie. V roce 1808 se Daltonova atomová teorie objevila prostřednictvím několika experimentů souvisejících se směsí plynů a znalostí prací navrhovaných Lavoisierem.
Postuláty Daltonovy atomové teorie
Daltonova atomová teorie byla založena na experimentech, ale žádný z těchto experimentů nemohl atom jasně odhalit. Dalton proto nazval atom nejmenší částí hmoty.
Daltonova teorie představuje mnohem více postulátů než důkazů. Podívejte se na některé z nich:
Atomy jsou masivní a sférického tvaru (podobné kulečníkové kouli);
Atomy jsou nedělitelné;
Atomy jsou nezničitelné;
Jeden chemický prvek je to sada atomů se stejnými vlastnostmi (velikost a hmotnost);
Atomy různých chemických prvků mají navzájem odlišné vlastnosti;
K jejich rozlišení lze použít relativní hmotnost dvou atomů;
Složená chemikálie je tvořena stejnou kombinací různých typů atomů;
Různé chemické látky vznikají spojením různých atomů.
Reprezentace daltonského atomového modelu
Dalton nazval svůj atomový model kulečníkovou koulí, a proto začal reprezentovat atomy prvků známých v jeho době pomocí sférických symbolů.
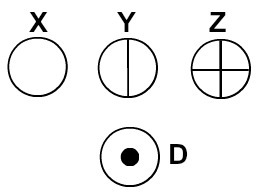
Atomy reprezentované podle Daltonovy atomové teorie
Každá atomová reprezentace, která má konkrétní detail, označuje jiný chemický prvek. Didakticky knihy a cvičení na základní a střední úrovni představují atomy pouze v koulích různých barev.
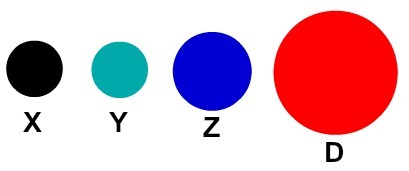
Didaktické znázornění atomů
Příspěvky Daltonovy atomové teorie
porozumění Lavoisierův zákon zachování mše
Francouzský chemik Lavoisier to tvrdil v roce 1785 „Při chemické reakci je hmotnost zachována, protože nedochází ani k tvorbě, ani k ničení atomů ”. Daltonova atomová teorie tuto skutečnost dokázala, protože jeden z jeho postulátů uvádí, že atom je nezničitelný.
Proto, pokud provádíme spalování uhlí (C) v přítomnosti plynného kyslíku (O2), budeme mít chemickou reakci mezi jedním atomem uhlíku a dvěma atomy kyslíku. Tato reakce vytvoří oxid uhličitý (CO2), který má přesně stejné atomy, které tvořily látky před reakcí.
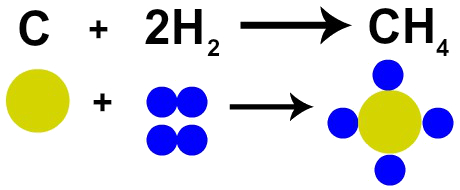
Zastoupení Lavoisierova zákona Daltonovým atomovým modelem
porozumění jednoduché látky
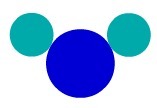
Za použití Daltonův atomový model, můžeme pochopit jednoduchou látku, tj. látku, která má atomy stejné vlastnosti tvořící molekulu. Proto máme atomy patřící ke stejnému chemickému prvku.
V podstatě F2například máme dva atomy fluoru, takže musíme použít dva typy stejných atomů v reprezentaci podle Daltonovy atomové teorie.

Jednoduché zastoupení látky podle Daltonův atomový model
porozumění složené látky
Ve složené látce máme atomy různých charakteristik, které tvoří molekulu. Proto máme různé chemické prvky tvořící látku.
Látka H2Například O má tři atomy: dva vodík a jeden kyslík. Podívejte se na jeho reprezentaci podle atomového modelu Daltona:
Reprezentace složené látky podle kůžeDaltonův atomový model
Pochopení směsí
Porozumění směsi (spojení dvou nebo více různých látek) prostřednictvím Daltonovy atomové teorie je jednoduché: jednoduše vložte dvě různé molekuly do stejné nádoby.

Znázornění druhé směsi Daltonův atomový model
Další vědecké příspěvky Johna Daltona
představil koncept atomová hmotnost;
Formuloval zákon parciálních tlaků plynů (Daltonův zákon);
Objevili jsme zrakové postižení tzv barvoslepost;
Studoval chování par a plynů při různých teplotách;
Zjistil, že všechny plyny expandují (snaží se obsadit určité místo) ve vesmíru stejným způsobem.
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm
