Články nebo elektrochemické články a baterie jsou zařízení, ve kterých se chemická energie spontánně přeměňuje na elektrickou energii.Článek je tvořen pouhými dvěma elektrodami a elektrolytem, zatímco baterie je sada baterií v sérii nebo paralelně.
Na primární baterie nejsou dobíjecí zařízeníkdyž přestane oxidačně-redukční reakce, která v nich probíhá, musí být zlikvidována.
U každého zařízení je uveden typ baterie a mezi aktuálně používanými primárními bateriemi jsou hlavní: Suché články Leclanché (běžné baterie nebo kyselé články), alkalické baterie a lithiové / oxidy manganičité.
Podívejte se, co je odlišuje a pro jaké vybavení jsou vhodné:
- Suché buňky Leclanché:
Tyto hromádky jsou v zásadě tvořeny zinkovým obalem, odděleným porézním papírem a centrální grafitovou tyčí obklopenou oxidem manganičitým (MnO2), práškové uhlí (C) a vlhká pasta obsahující chlorid amonný (NH4Cl), chlorid zinečnatý (ZnCl2) a voda (H2Ó).
Ó zinek funguje jako anoda, ztrácí elektrony; to je grafit funguje jako katoda, vedení elektronů na oxid manganičitý:
Anoda s poloviční reakcí: Zn (s) → Zn2+(tady) + 2 a-
Semi-reakce katody: 2 MnO2 (aq) + 2 NH41+(tady) + 2e- → 1 Mn2Ó3(s) + 2NH3 (g) + 1 hodina2Ó(1)
Globální reakce: Zn (s) + 2 MnO2 (aq) + 2 NH41+(tady) → Zn2+(tady) + 1 mil2Ó3 (s) + 2NH3 (g)
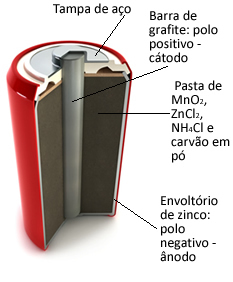
Tento typ baterie je vhodný pro zařízení vyžadující lehké a trvalé vybití, jako je dálkové ovládání, nástěnné hodiny, přenosné rádio a hračky.
Více podrobností o původu, fungování, životnosti, DDD, nebezpečích a opatřeních, která je třeba u těchto baterií dodržet, získáte v textu „Leclanché Dry Stack”.
Nepřestávejte... Po reklamě je toho víc;)
- Alkalinové baterie:
Jeho funkce je velmi podobná operaci suchých buněk Leclanché, avšak jediný rozdíl je v tom, že místo chloridu amonné soli (což je kyselá sůl), přidá se silná báze, zejména hydroxid sodný (NaOH) nebo hydroxid draselný (KOH).
Anoda s poloviční reakcí: Zn + 2 OH → ZnO + H2O + 2e-
Semi-reakce katody: 2 MnO2 + H2O + 2e-→ Mn2Ó3 + 2 OH
Celková reakce: Zn +2 MnO2→ ZnO + Mn 2Ó3

Alkalické baterie jsou výhodnější než kyselé v tom smyslu, že mají delší životnost obvykle poskytuje o 50–100% více energie než běžná baterie stejné velikosti, navíc je zde menší nebezpečí netěsnosti.
Jsou určeny hlavně pro zařízení, která vyžadují rychlé a intenzivnější stahování, jako jsou rádia, přenosné přehrávače CD / DVD a MP3, baterky, digitální fotoaparáty atd.
Přečtěte si také text Alkalinové baterie.
- Lithiové / manganičité baterie:
Tyto baterie jsou lehké a vytvářejí velké napětí (asi 3,4 V), proto se často používají v malých zařízeních, jako jsou hodinky a kalkulačky. Na rozdíl od předchozích případů je jeho formát měna, jak ukazuje následující obrázek:

Anoda je lithium, katoda je oxid manganičitý a elektrolyt je solný roztok:
Anoda s poloviční reakcí: číst →číst+ + a−
Katodová semi-reakce: MnO2 + číst+ + a−→MnO2(li)
Celková reakce: Li + MnO2 → MnO2(li)
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Nejběžnější typy článků a primárních baterií“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Zpřístupněno 27. června 2021.

