THE úhlová geometrie je jedním z několika typů molekulární geometrie, které mohou být stále lineární, pyramidové, ploché trigonální, čtyřboká, atd. Úhlovou geometrii lze nalézt pouze u molekul, které mají následující vlastnosti:
Triatomika, to znamená, že mají pouze tři atomy;
Mějte alespoň tři elektronové mraky v centrálním atomu.
Poznámka: elektronický cloud je vše kovalentní vazba (jednoduché, dvojité, trojné nebo souřadnice) mezi atomy a elektronovými páry valenční vrstva kteří se neúčastní hovoru.
Podívejte se na několik příkladů molekul, které mají úhlovou geometrii:
1. příklad: voda (H2Ó)

konvenční vodní konstrukce
Ve struktuře vody máme:
Tři atomy: dva vodíky a jeden kyslík;
Kyslík je centrální atom, protože vytváří větší počet vazeb (dvě, protože patří do rodiny VIA);
Dvě jednoduché vazby mezi kyslíkem a vodíky. Je to proto, že každý vodík může vytvořit pouze jednu vazbu a kyslík dvě vazby;
Čtyři nevázané elektrony v kyslíku, protože má šest elektronů ve valenčním plášti a ve vazbách používá pouze dva.
Proto, stejně jako v molekule vody, jsou v centrálním atomu tři atomy a čtyři elektronická mračna (dvě jednoduché vazby a dva nevázané páry elektronů) geometrie je úhlová.
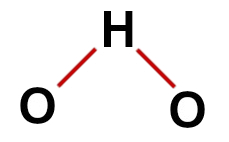
Správný strukturní vzorec vody
Poznámka: Kdykoli molekula prezentuje tyto vzorce, úhel vytvořený mezi atomy je přibližně 109 ° 28'.
2. příklad: Oxid siřičitý (SO2)

Konvenční struktura oxidu siřičitého
Ve struktuře oxidu siřičitého máme:
Tři atomy: dva kyslíky a jeden atom síry;
Síra je centrální atom, protože je nejmenším prvkem v molekule, protože všechny prvky musí vytvářet stejný počet vazeb (dvě);
Dvojná vazba mezi sírou a jedním z kyslíků. Je to proto, že oba potřebují dvě spojení;
Jeden souřadnicová nebo dativní kovalentní vazba, protože síra byla po párování s druhým kyslíkem stabilní, ale stále existuje atom kyslíku, který potřebuje dva elektrony;
Čtyři nezávazné elektrony v kyslíku. Je to proto, že kyslík má ve valenčním plášti šest elektronů a ve vazbách používá pouze dva.
Stejně jako v molekule oxidu siřičitého jsou tedy v centrálním atomu tři atomy a čtyři elektronická mračna (dvě jednoduché vazby a dva páry nevazebných elektronů) geometrie je úhlová.
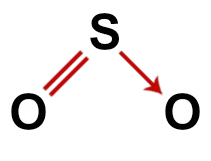
Správný strukturní vzorec oxidu siřičitého
Poznámka: Kdykoli má molekula tyto vzorce, úhel mezi atomy je přibližně 120Ó.
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm

