aktivní izomery nebo opticky aktivní izomery (IOA) jsou molekuly určité chemické látky, které mohou provádět polarizaci a odchylku plán světlo pravý nebo levý. Chcete-li zkontrolovat, zda má látka aktivní izomery, stačí zkontrolovat, zda je ve strukturním vzorci asymetrický uhlík:

Analýzou řetězce znázorněného na obrázku výše můžeme vidět, že centrální uhlík má čtyři různé ligandy (OH, H, CH3 a Cl), což z něj dělá a uhlík asymetrický, nazývaný také uhlík chirální. Kdykoli má řetězec jeden nebo více chirálních atomů uhlíku, budou tedy existovat aktivní izomery.
Vy typy aktivních izomerů(IOA) oni jsou:
Pravák: Aktivní optický izomer, který ohýbá polarizované světlo doprava;
Levogiro: Aktivní optický izomer, který ohýbá polarizované světlo doleva.
Pozorování: Přítomnost asymetrického uhlíku ve strukturním vzorci naznačuje, že látka musí mít levotočivý izomer a pravotočivý izomer. Není na nás, abychom věděli, jakým způsobem bylo světlo odkloněno, protože přítomnost chirálního uhlíku již tuto skutečnost dokazuje. Polovina existujících molekul je vždy levák a druhá polovina jsou praváci.
Levostranné a pravostranné molekuly jakékoli organické látky mají vždy stejné fyzikální vlastnosti (bod tání, bod varu, hustota, rozpustnost atd.), ale představují chemické aktivity (chování v organismu) mnoho různých. Příkladem je adrenalin. V těle působí pouze molekula adrenalinu levogyra, zatímco dextrogyra ne.
Podívejte se nyní na strukturní vzorec butan-2-olové látky a zkontrolujte, zda obsahuje aktivní izomery či nikoli:
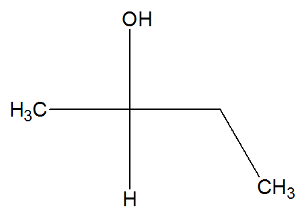
Ve struktuře butan-2-olu můžeme pozorovat, že uhlík 2 má čtyři různá pojiva (OH, H, CH3, CH2-CH3), takže se jedná o chirální uhlík a představuje pravotočivý aktivní izomer a další levotočivý aktivní izomer.
Výpočet aktivních izomerů (IOA)
Nizozemský chemik Jacobus Henricus van't Hoff vyvinul vzorec, který umožňuje výpočet, kolik aktivních izomerů (IOA) může daná látka obsahovat. Dívej se:
IOA: 2Ne
n: je počet chirálních uhlíků ve strukturním vzorci látky.
Postupujte podle dvou příkladů použití vzorce Vant't Hoff:
Kyselina 5-dichlor-2,3-dihydroxyhexandiová

Ve strukturním vzorci sloučeniny jsou tři chirální uhlíky nebo asymetrické, proto:
IOA = 2Ne
IOA = 23
IOA = 8
2,3,4,5-tetrahydroxyhexanal

Ve strukturním vzorci sloučeniny jsou čtyři chirální uhlíky (červené šipky) nebo asymetrické, proto:
IOA = 2Ne
IOA = 24
IOA = 16
Pozorování: Existuje možnost, že strukturní vzorec má dva asymetrické uhlíky, které mají přesně stejné ligandy. Pokud k tomu dojde, uvažujeme ve výpočtech pouze 1 pro hodnotu n, nikoli 2. Viz příklad:
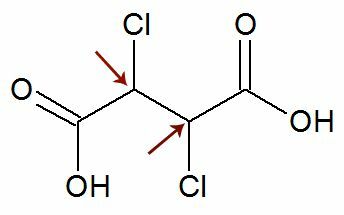
Jako dva chirální uhlíky oni jsou se rovná, považujeme pouze za jednu uhlík ve výpočtu:
IOA = 2Ne
IOA = 21
IOA = 2
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm
