Sulfonační reakce v alkanech oni jsou organické substituční reakce, prováděné s cílem výroby sulfonové kyseliny (organické sloučeniny, které mají skupinu SO3H připojený k atomu uhlíku nebo k uhlíkovému řetězci) a voda (H2Ó).
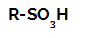
Strukturní vzorec kyseliny sulfonové
Za provedení sulfonační reakce dne alkany, musíme smíchat alkan (sloučenina tvořená uhlíkovým řetězcem nasyceným pouze atomy uhlíku a vodíku) a kyselina sírová (H2POUZE4) koncentrovaný, vystavený zahřívání (∆).
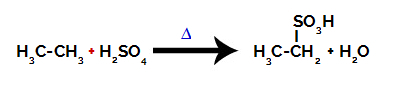
Chemická rovnice představující sulfonaci alkanu se dvěma uhlíky
Principy sulfonační reakce v alkanech
Jako alkansulfonační reakce je to substituční reakce, máme v ní výměnu mezi menšími složkami elektronegativita reaktantů, tj. mezi alkanem a kyselinou sírovou. Alkan má vodík a kyselinu sírovou, sulfonovou skupinu.
Níže máme krok za krokem mechanismus a sulfonační reakce v alkanech. Jako příklad použijeme nejjednodušší alkan, metan (CH4):
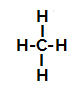
Strukturní vzorec metanu
1. krok: Narušení vazby mezi hydroxylem (OH) a sírou (S) v kyselině sírové.
Každá hydroxylová skupina přítomná v kyselině sírové se vyznačuje tím, že je více elektronegativní. Při zahřívání během reakce je tendence, že vazba mezi hydroxylovou skupinou a sírou je přerušena:
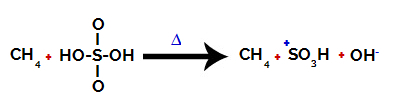
Narušení vazby mezi sírou a hydroxylovou skupinou
K rozbití vazby všech hydroxylových skupin však nedochází kvůli elektronickému přeskupení ve struktuře. Poté se získá hydroxidový anion (OH).-) a sulfonový kation.
2. krok: Útok hydroxylové skupiny na molekulu alkanu.
Poté hydroxyskupina (OH-) provádí útok na alkán, což způsobuje porušení vazby mezi uhlíkem a vodíkem (což je křehčí kvůli rozdílu v elektronegativitě mezi nimi).
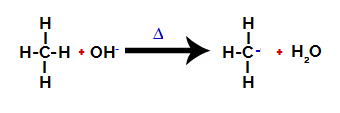
Přerušení vazby mezi uhlíkem a vodíkem v alkanu
Poznámka: K narušení vazby mezi uhlíkem a vodíkem vždy dojde nejčastěji na uhlíku s nižší elektronovou hustotou nebo nábojem. Čím méně uhlíku má atom vodíku nebo čím více skupin k němu je připojeno, tím nižší je jeho elektronová hustota. Takže máme:
Terciární uhlík
Po rozbití vazby se z alkanu stane uhlík s nedostatkem elektronů (karbokation). Hydroxidová skupina (OH)-) interaguje s uvolněným vodíkem a tvoří molekulu vody.
3. krok: Útok vytvořeného radikálu na sulfonovou skupinu.
Nakonec je sulfonová skupina napadena zbytkem alkanu za vzniku kyseliny sulfonové.
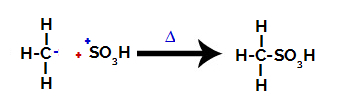
Struktury, které interagují a tvoří kyselinu sulfonovou
Příklady rovnic představujících sulfonační reakce v alkanech
1. příklad: Sulfonace propanu.
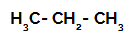
Strukturní vzorec propanu
Propan má dva primární uhlíky a jeden sekundární uhlík, které mají různé náboje, protože jsou vázány na různá množství vodíku. Protože uhlík je více elektronegativní než vodík, mají tyto uhlíky různé hustoty elektronů.
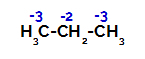
Rozdělení nábojů na každý atom uhlíku propanu
Na primárních uhlících je náboj -3 (protože je vázán na tři vodíky) a na sekundárním uhlíku je náboj -2 (protože je vázán na dva vodíky). Dojde tedy k přerušení vazby mezi uhlíkem a vodíkem, někdy na uhlíku 1 (jedné molekuly), někdy na uhlíku 2 (jiné molekuly).
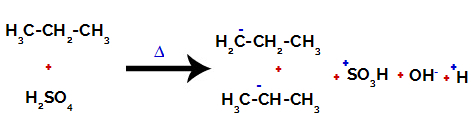
Přerušení vazby mezi uhlíkem a vodíkem na různých uhlících
Po přestávkách mezi vazbami, jak v kyselině sírové, tak v alkanu, dochází k tvorbě produkty s nahrazením vodíku na uhlíku 1 sulfonovou skupinou a totéž se děje na uhlíku 2.
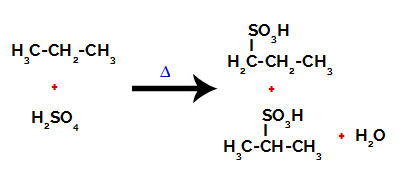
Produkty vzniklé sulfonací propanu
2. příklad: Sulfonace 2-methyl-butanu.

Strukturní vzorec 2-methyl-butanu
2-Methyl-butan má tři primární uhlíky, sekundární uhlík a terciární uhlík, které mají různé náboje a následně různé elektronické hustoty, jak je patrné z následující struktury:
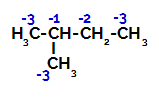
Distribuce elektronických nábojů ve 2-methyl-butanu
Proto ve 2-methyl-butanu existuje několik možností prolomení vazby mezi uhlíkem a vodíkem, které se mohou vyskytovat na uhlíku 1 (molekule), uhlíku 2 (jiné molekule), uhlíku 3 nebo uhlíku 4. Je však pozoruhodné, že narušení na uhlíku číslo 2 je častější.
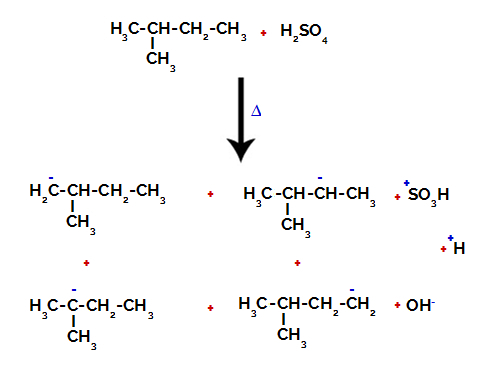
Přerušení vazby mezi uhlíkem a vodíkem na různých uhlících
Po rozbití mezi vazbami, jak v kyselině sírové, tak v alkanu, vznik produkty s nahrazením vodíku na uhlíku 1 sulfonovou skupinou a totéž se děje na uhlík 2.

Produkty vzniklé sulfonací 2-methyl-butanu
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm