Kovalentní vazby se mohou vyskytovat v molekulární nebo datové a souřadnicové formě.
Molekulární kovalentní vazba
V této vazbě jsou atomy spojeny kvůli sdílení jejich elektronů, poté se objeví elektronické páry označené kruhem:
Molekulární kovalentní vazba dvou atomů chloru (Cl).
Každý elektronický pár vytvořený současně patří ke dvěma atomům. Molekuly jsou elektricky neutrální struktury, protože nedochází ani k zisku, ani ke ztrátě elektronů, pouze k jejich sdílení.
Voda je molekulární sloučenina složená ze dvou atomů vodíku (H2) a jeden kyslík (O).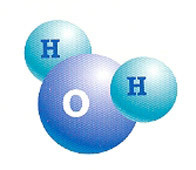
dativní a koordinovat kovalentní vazbu
Tato vazba se řídí teorií oktetu: Atomy se spojí a snaží se získat osm elektronů ve valenčním plášti, tj. Elektronickou konfiguraci vzácných plynů.
Atom, který již dosáhl elektronické stability, se tedy připojí k dalšímu, který potřebuje elektrony k dokončení valenčního pláště. Příkladem této vazby je, když se atom síry váže se dvěma atomy kyslíku za vzniku oxidu siřičitého (SO2).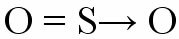
Atom síry (S) získává svůj oktet vytvořením dvojné vazby s kyslíkem umístěným vlevo (koordinovaná vazba), ale zároveň kyslík umístěný vpravo potřebuje elektrony, aby jej dokončil oktet. Poté se objeví dativní kovalentní vazba představovaná malým vektorem (šipka). Šipka označuje, že
Podívejme se na sdílení elektronů při tvorbě sloučeniny oxidu sírového (SO3).
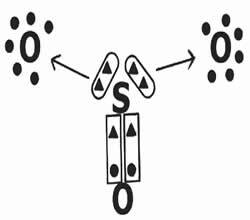
Všimněte si, že centrální prvek (síra) vytváří dvojnou vazbu (koordinovanou) s jedním z kyslíků a dosahuje elektronické stability (osm elektronů ve valenčním plášti). Na druhou stranu daruje dva páry elektronů kyslíkům (dativní vazba označená šipkou →) ve snaze dokončit oktet.
Líria Alves
Vystudoval chemii
Vidět víc!
Kovové spojení
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/ligacao-covalente.htm
