anorganické soli jsou tvořeny iontovou asociací alespoň jednoho kationtu (tvořeného jakýmkoli kovem nebo amoniem) a aniontu (jednoduchého nebo sloučeného).
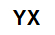
Obecný molekulární vzorec soli
Po přidání do vody se soli disociují a uvolňují alespoň jeden kationt jiný než hydronium (H+) a anion jiný než hydroxid (OH.)-).
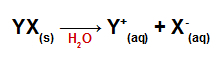
Disociační rovnice pro jakoukoli sůl
Klasifikace solí
Soli mohou obecně mít následující klasifikace:
jednoduchá sůl: sůl tvořená pouze jedním kationtem a jedním aniontem. Příklady: NaCl, CaSO4, KCN, NH4CO3 atd.
Hydrogenovaná sůl: má dva kationty (z nichž jeden musí být hydronium) a anion. Příklady: NaHCO3, CaHBO3 atd.
Hydroxylová sůl: má kation a dva anionty (z nichž jeden musí být hydroxid). Příklady: MgOHCl, Al (OH)2ClO3 atd.
Hydratovaná sůl: představuje molekuly vody spojené s jeho krystalickou strukturou. Příklady: CaCl2.2H2O, CuSO4.6H2Atd.
Podvojná sůl: má dva kationty (všechny odlišné od hydronia) a jeden anion nebo jeden kation a dva anionty (všechny odlišné od hydroxidu). Příklady: Typ4CN, AgFeBO3 atd.
Kamenec: je sůl tvořená dvěma sulfáty s NOx kationty rovnými +1 a +3 plus 24 molekul vody. Příklady: Ag2POUZE4. Al2(POUZE4)30,24 hod2na2POUZE4.Sb2(POUZE4)30,24 hod2Ó
Pravidlo pojmenování soli
Název anionu + název de + kationtu
→ K.3PRACH4
Sůl má fosfátový anion (PO4-3) a draselný kation (K.+1), proto se jmenuje fosforečnan draselný.
→ Případ3
Sůl má siřičitanový anion (SO3-2) a kationt vápníku (Ca+2), proto se jmenuje siřičitan vápenatý.
POZNÁMKA: Pokud kation není stříbro, zinek nebo prvek, který patří do rodin IA, IIA a IIIA, musíme označit jeho NOX římskou číslicí před jménem kationtu.
→ Cu2POUZE4
Sůl má síranový anion (SO4-2) a kationt vápníku (Cu+1), proto se jmenuje síran měďnatý I.
Hydrogenovaná sůl: U této soli musíme před název aniontu napsat předponu týkající se množství vodíku ve vzorci. Tato předpona musí být oddělená od slova vodík pomlčkou.
→ NaHCO3
Sůl má hydrogenuhličitanový anion a kation sodný, takže se jmenuje monohydrogenkarbonát sodný.
Hydroxylová sůl: U této soli musíme před název aniontu napsat předponu odkazující na množství hydroxylových skupin ve vzorci. Tato předpona musí být oddělená od slova hydroxy pomlčkou.
→ Al (OH)2ClO3
Sůl má dva hydroxyly, chlorečnanový anion a kation hliníku, takže se jmenuje dihydroxychlorát hlinitý.
Hydratovaná sůl: U této soli musíme za název kationu napsat předponu týkající se množství molekul vody ve vzorci. Tato předpona musí být oddělená od slova hydratovaný pomlčkou.
→ CaCl2.2H2Ó
Sůl má dvě molekuly vody, chloridový anion a kation vápníku, takže se jmenuje dihydrát chloridu vápenatého.
Podvojná sůl se dvěma kationty: U této soli musíme napsat dvojité slovo v závorkách za názvem anionu a poté za nejvíce elektropozitivní název kationu a druhý kation.
→ AgFeBO3
Tato sůl má kromě borátového aniontu také stříbro (více elektropozitivní kation) a kation železa II. Jeho název je boritan (dvojitý) stříbra a železa II.
-
Podvojná sůl se dvěma anionty:
Název nejvíce elektronegativního anionu + spojovník + název nejméně elektronegativního anionu + název de + kationtu
→ Typ4CN
Tato sůl obsahuje kationt titanu IV, kromě fosforečnanu (elektronegativnější anion) a kyanidového aniontu. Jeho název je kyanid titaničitý fosfát IV.
Kamencová sůl: U této soli ignorujeme obecné pravidlo. Stačí napsat výraz kamenec následovaný názvem kationu náboje +3 a názvem kationu náboje +1, odděleny spojkou e.
→ V2POUZE4.Sb2(POUZE4)30,24 hod2Ó
Kamenitá sůl má kation +3 antimon a kation +1 sodík, takže se jmenuje kamenec a antimon III.
Fyzikální vlastnosti solí
Jsou pevné při pokojové teplotě;
Mají vysoké teploty tání a varu;
Jsou vytvořeny z iontových vazeb;
Vedou elektrický proud v kapalném stavu (po fúzi) nebo po rozpuštění ve vodě;
Obecně lze říci, že jsou rozpustné ve vodě, ale existují i soli, které jsou považovány za prakticky nerozpustné.
Chemické vlastnosti solí
Soli jsou sloučeniny, které mají schopnost chemicky reagovat (za předpokladu, že nemají stejný kation nebo stejný anion jako jiná látka) s několika skupinami látek, a to:
Při dvojité výměnné reakci s kyselinou tvoří novou sůl a novou kyselinu.
Při dvojité výměnné reakci s bází: tvoří novou sůl a novou bázi.
V reakce dvojité výměny s jinou solí: tvoří dvě nové soli.
Některé soli mají schopnost trpět rozklad když je vystaven teplu, tvoří dvě nebo více nových látek. Pokud zahřeme hydrogenuhličitan sodný (NaHCO3), například se rozloží a vytvoří uhličitan sodný (Na2CO3), voda (H2O) a oxid uhličitý (CO2).
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-sais-inorganicos.htm


