THE elektronegativita je to tendence atomu přitahovat elektrony k sobě, když je spojen s jiným chemickým prvkem. prostřednictvím kovalentní vazby, tj. ve které dochází ke sdílení elektronů, přičemž tuto molekulu považujeme za izolovaný.
Zvažme dva příklady, abychom lépe porozuměli představenému konceptu:
1. příklad: Molekula plynného vodíku: H2 → H - H
Když se dva atomy vodíku spojí, přitahovací síly mezi jádry každého z nich nastanou současně. jeden z těchto atomů elektronem druhého atomu a odpudivé síly mezi elektrony a jádry těchto dvou atomů atomy. Když tyto síly dosáhnou rovnováhy, oba elektrony se nacházejí v oblasti elektrospher, která je někde mezi nimi. atomy molekuly, ve kterých oba interagují se dvěma elektrony, stávají se stabilními, to znamená, že oba atomy sdílejí pár elektrony.
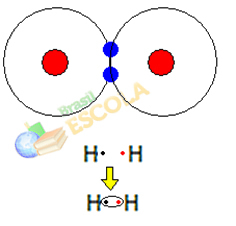
Toto je kovalentní vazba, která tvoří molekulu. Ale protože dva atomy této molekuly jsou přesně stejné, způsob, jakým k sobě přitahují elektrony, je také stejný. Tak to říkáme neexistuje žádný rozdíl elektronegativity nebo že ona je to nepolární.
2. Příklad: Molekula chlorovodíku: HCℓ
V tomto případě se sdílení elektronového páru provádí mezi různými prvky, protože v této souvislosti atom chloru přitahuje elektrony s větší intenzitou než vodík. Proto říkáme, že chlor je více elektronegativní než vodík.
Jak je znázorněno na obrázku níže, kvůli rozdílu v elektronegativitě, a elektrický dipól (μ), což jsou dva elektrické monopoly, přičemž elektrony mají tendenci být více přitahovány k chloru. Takže vazba H ─ Cℓ bude mít na chloru částečný záporný náboj (δ-) a částečný kladný náboj na vodíku (δ+). Toto je molekula s rozdílem elektronegativity a je polární:
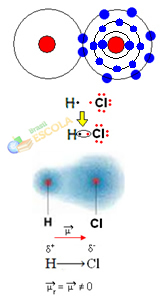
To nám ukazuje, že elektronegativita je spíše relativní než absolutní veličina, protože je určena zohledněním srovnání sil vyvíjených atomy v kovalentní vazbě.
Existuje několik způsobů, jak vypočítat elektronegativitu, ale nejběžnější je stupnice elektronegativity navržená Paulingem. Řekněme, že máme generickou molekulu A ─ B. Pauling navrhl, aby vazebná energie této molekuly, symbolizovaná D, byla dána součtem aritmetického průměru vazebných energií (D) molekul plynu těchto dvou atomů, tj. A-A a B-B, s druhou mocninou rozdílu v elektronegativitách každého atomu této molekuly (XTHE a xB):
D(A-B) = [D(A-A) + D.(B-B)] + k (xTHE - XB)2
Konstanta k ve výše uvedeném vzorci se rovná 96,5 kJ. mol-1. Pauling přidělil libovolnou hodnotu pro elektronegativitu vodíku, která byla 2,1, a tímto způsobem bylo možné zjistit hodnotu elektronegativity ostatních prvků ve vztahu k on.
Na základě této metody byly uvedeny Paulingovy hodnoty elektronegativity pro prvky periodické tabulky, s výjimkou vzácných plynů.

Všimněte si, že tyto hodnoty jsou periodickou vlastností, protože se periodicky mění v závislosti na atomových číslech prvků. Podívejte se například na to, že nejvíce elektronegativními prvky jsou ty v pravém horním rohu tabulky, to znamená fluor (4.0) a kyslík (3.5) a nejméně elektronegativní jsou ty v levém dolním rohu, které jsou francium (0,8) a cesium (0,8).
Na základě toho byla dokonce vytvořena řada elektronegativity nejvíce elektronegativních prvků, které mají tendenci pracovat nejvíce:
F> O> N> Cℓ> Br> I> S> C> P> H
Podívejte se na hodnoty elektronegativity:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Existuje určitý druh „triku“ k vyzdobení této řady elektronegativity, který je dán větou níže, ve které iniciála každého slova odpovídá symbolu dotyčných prvků:
“FAhoj Ónemít NÓ Clube, brmám JásAu Cumírající Ppro Hnemocnice"
Takže to můžeme říci elektronegativita je periodická vlastnost, která se v Periodické tabulce zvyšuje zleva doprava a zdola nahoru.

Je to z důvodu velikosti atomového poloměru. Čím větší je poloměr atomu, tím dále jsou sdílené elektrony od jeho jádra, a proto je slabší přitažlivost mezi nimi. Opak je také pravdou, čím menší je poloměr atomu, tím blíže budou elektrony jádru a tím větší bude přitažlivost mezi nimi. Můžeme tedy uzavřít následující:
Elektronegativita se zvyšuje se zmenšujícím se atomovým poloměrem.
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/eletronegatividade.htm
