difúze a výpotek jsou dva zákony navržené skotským chemikem Thomasem Grahamem v 19. století na základě jeho studií o směsi plynů a chování plyny při procházení zdmi kontejneru.
Z pozorování Thomase Grahama o chování plynů ve vztahu k difúzi a výpotku můžeme zdůraznit následující:
Plyn má vždy tendenci procházet malými otvory přítomnými v pevné fázi;
Čím větší hmotnost molekuly plyn, tím větší je jeho obtížnost procházet otvory pevné látky;
Čím nižší je hustota plynu, tím větší je rychlost jeho pohybu;
Čím vyšší je teplota, které je plyn vystaven, tím větší je rychlost, jakou se šíří do prostředí nebo prochází otvorem;
- Plyn nikdy nezůstává na určitém místě statický.
Difúze
Difúze jedná se o fyzikální jev, který spočívá ve schopnosti plynu difundovat (tj. šířit se) po celém prostoru oblasti nebo uvnitř nádoby. Z tohoto důvodu můžeme říci, že v prostoru není plyn nikdy omezen na jediné místo.

Reprezentace výskytu vysílání
Kromě toho můžeme definovat difúze stále jako kapacita, kterou musí jeden plyn smíchat s druhým, když je umístěn ve stejné nádobě, a vytváří homogenní plynnou směs.
Příkladem je situace, kdy z výfuku vozidla vycházejí plyny. Jakkoli jsou toxické, nezpůsobují krátkodobé poškození člověka, protože se šíří atmosférickým vzduchem a následně snižují jejich koncentraci.
Výpotek
Výpotek jedná se o fyzikální jev, který spočívá v průchodu plynu otvory ve stěnách určité nádoby, to znamená, že spočívá ve výstupu plynu z jednoho prostředí do druhého.

Znázornění výskytu výlevu
Příkladem je, když jsou balónky nafouknuty na večírek a následující den jsou všechny vyfouknuty, a to vše kvůli vzduchu unikajícímu otvory v balóncích.
Výpočty související s difúzí a výpotkem
Můžeme vypočítat podle rovnic navržených Grahamem rychlost, jakou plyn funguje difúze nebo výpotek. Podle Grahama jsou rychlosti difúze a výpotku dvou plynů smíchaných v nádobě vždy nepřímo úměrné druhé mocnině jejich relativních hustot nebo jejich molárních hmot.
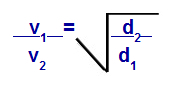
Grahamův zákon s ohledem na hustotu
proti1 = rychlost (výpotek nebo difúze) plynu 1 ve směsi;
proti2 = rychlost (výpotek nebo difúze) plynu 2 ve směsi;
d1 = hustota plynu 1 směsi;
d2 = hustota plynu 2 směsi;
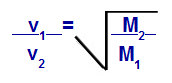
Grahamův zákon týkající se molární hmotnosti
proti1 = rychlost (výpotek nebo difúze) plynu 1 ve směsi;
proti2 = rychlost (výpotek nebo difúze) plynu 2 ve směsi;
M1 = molární hmotnost plynu 1 směsi;
M2 = molární hmotnost plynu 2 ve směsi.
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm


