Některé sloučeniny pro dosažení stability nepotřebují mít ve valenčním plášti osm elektronů, proto jsou považovány za výjimky z oktetového pravidla. Zjistěte nyní, proč některé prvky unikají povinnosti mít v poslední skořápce oktet elektronů.
Berýlium (Být)
Je výjimkou z oktetového pravidla, protože je schopen tvořit sloučeniny se dvěma jednoduchými vazbami, takže se stabilizuje pouze se čtyřmi elektrony ve valenčním plášti. 
Jelikož se vodík (H) musí vzdát dvou elektronů, aby vytvořil vazbu (H - No - H), atom berylia (Be) sdílí své elektrony a dosahuje stability.
Hliník (Al)
Jedná se o výjimku z oktetového pravidla, protože dosahuje stability se šesti elektrony ve valenčním plášti. Atom hliníku má tendenci darovat své elektrony, a tak může tvořit tři jednoduché vazby s jinými atomy: 
V tomto případě hliník (Al) vytvořil tři vazby se třemi atomy fluoru (F).
Bor (B)
Tvoří molekulární látky se třemi jednoduchými vazbami. 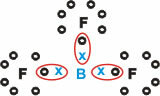
Všimněte si, že bor (B) má tendenci darovat své elektrony atomům fluoru (F), které se řídí oktetovým pravidlem, které vyžaduje osm elektronů ve valenčním plášti. Když se bor vzdává svých elektronů, fluor se stabilizuje s vytvořeným oktetem.
Líria Alves
Vystudoval chemii
Tým brazilské školy
Vidět víc!
Teorie oktetu
Obecná chemie - Chemie - Brazilská škola
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm
