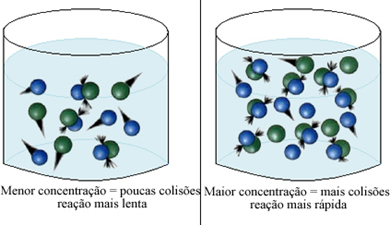
To si můžeme všimnout kdykoli zvýšíme koncentraci jednoho nebo všech reaktantů účastnících se chemické reakce, dojde ke zvýšení jeho rychlosti vývoje, tj. rychlosti reakce.
Opak je také pravdou. Například se v současné době doporučuje, abychom místo běžného alkoholu používali alkoholový gel, protože existuje menší riziko jeho vznícení a zabránění nehodám. Obyčejný tekutý alkohol je ve skutečnosti směs alkoholu a vody, přičemž gelový alkohol obsahuje menší množství alkoholu. Proto, když se sníží koncentrace jednoho ze spalovacích reaktantů, v případě alkoholu probíhá reakce pomaleji. Na druhou stranu, čím je alkohol čistší, tím rychlejší je reakce spalování.

Jak je uvedeno v textu Podmínky pro výskyt chemických reakcí, jednou z podmínek pro reakci je efektivní kolize mezi částicemi. Tím pádem, zvýšení koncentrace činidel umožňuje mít ve stejném prostoru větší množství částic nebo molekul. To zvyšuje množství kolizí mezi nimi a také zvyšuje pravděpodobnost, že dojde k účinným kolizím, které budou mít za následek reakci. Výsledkem je, že reakce probíhá rychleji.
Chcete-li to vidět, zamyslete se nad následujícím příkladem: když máme hořící uhlík a chceme, aby toto spalování probíhalo rychleji, foukneme nebo rozdmýcháme oheň? Proč to funguje?
Jedním z reaktantů v této spalovací reakci je kyslík ve vzduchu. Když se otřásáme, proud vzduchu odstraní popel, který se tvoří během spalování, což usnadňuje kontakt kyslíku s uhlíkem. Tímto způsobem zvyšujeme kontakt mezi reaktanty a urychlujeme spalovací reakci.
Stručně, máme:

Při práci s plyny je jedním ze způsobů, jak zvýšit koncentraci reaktantů snižte tlak. Když to uděláme, zmenšíme objem a v důsledku toho dojde ke zvýšení koncentrací činidla.

Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm