podvojná sůl je jméno dané jedné z klasifikací, která anorganické soli může přijímat. Ostatní klasifikace jsou: jednoduchá, kamenec, hydroxylovaný, hydrogenovaný a hydratované. Aby mohla být anorganická sůl charakterizována jako podvojná sůl, musí mít jednu z níže popsaných kombinací:
Kation (Y) a jakékoli dva anionty (X a W), a je reprezentován následujícím vzorcem:
YXW
Anion (X) a jakékoli dva kationty (Y a Z), a je reprezentován následujícím vzorcem:
YZX
Poznámka: Tyto soli se tvoří, když a neutralizační reakce se provádí mezi dvěma základny jiný a jeden kyselinanebo mezi dvěma různými kyselinami a zásadou.
Pravidlo pojmenování podvojné soli
Jmenovat a podvojná sůlJe nejprve nutné znát jeho složení, protože pro každý typ podvojné soli existuje zvláštní pravidlo nomenklatury, jak je vidět níže:
a) Pravidlo nomenklatury pro podvojnou sůl se dvěma kationty
Když jeden podvojná sůl má dva kationy, musíme použít následující pravidlo:

Pravidlo nomenklatury používané pro dvojné soli se dvěma kationty
Následují dva příklady použití tohoto pravidla pojmenování:
1. příklad: Čára4s
Tato sůl se skládá z:
Anion: sulfid (S.-2);
Elektropozitivnější kation: lithium (Li+1);
Méně elektropozitivní kation: amonium (NH4+1).
Proto se jmenuje lithium (dvojitý) amoniumsulfid.
2. příklad: RbCaBO3
Tato sůl se skládá z:
Anion: boritan (BO3-3);
Elektropozitivnější kation: rubidium (Rb+1);
Méně elektropozitivní kation: vápník (Ca+2).
Jmenuje se tedy borát (dvojitý) rubidia a vápníku.
b) Pravidlo nomenklatury pro podvojnou sůl se dvěma anionty
Když jeden podvojná sůl má dva anionty, musíme použít následující pravidlo:
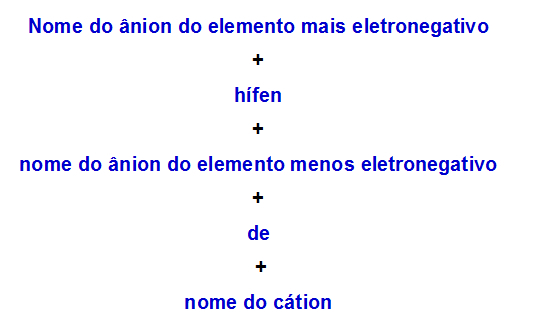
Pravidlo nomenklatury používané pro dvojné soli se dvěma anionty
Zde jsou dva příklady použití tohoto pravidla:
1. příklad: MgFI
Tato sůl se skládá z:
Kation: hořčík (Mg+2);
Nejvíce elektronegativní anion: fluorid (F-1);
Méně elektronegativní anion: jodid (I.-1).
Proto se jmenuje fluorid-jodid hořečnatý.
2. příklad: ZnNO2br
Tato sůl se skládá z:
Kation: zinek (Zn+2);
Elektronegativnější anion: dusitan (NO2-1);
Méně elektronegativní anion: bromid (Br-1).
Proto se jmenuje nitrit-bromid zinečnatý.
Sestavení vzorce podvojné soli z jeho nomenklatury
a) Podvojná sůl se dvěma kationty
Konstrukce vzorce a podvojná sůl záleží na tom, zda znáte jeho název, který je standardizovaný jako ve všech solích, tj. nejprve kation a poté anion. Vzhledem k tomu, že podvojná sůl může mít dva kationty, jejich pořadí a umístění ve vzorci se řídí křestním jménem.
1. příklad: pyrofosforečnan barnatý nikl II
Tato sůl obsahuje fosfát (P2Ó7), baryum (Ba+2) a nikl II (Ni+2), kationty napsané v tomto pořadí. Takže jeho vzorec je BaNiP2Ó7.
2. příklad: fosforečnan měďnatý II a zlato I.
Tato sůl obsahuje fosfát (PO4-3), měď II (Cu+2) a zlato I (Au+1), kationty napsané v tomto pořadí. Proto je jeho vzorec CuAuPO4.
b) Podvojná sůl se dvěma anionty
V případě podvojná sůl se dvěma anionty také sledujeme, při umisťování aniontů do vzorce, pořadí, v jakém se objevují v daném jménu.
1. příklad: síran nikelnatý jodid III
Tato sůl má síranové anionty (SO4-2) a jodid (I-1), napsané v tomto pořadí, a kationt niklu III (Ni+3). Takže jeho vzorec je NiSO4I.
2. příklad: kyanid fosforečnan olovnatý IV
Tato sůl má fosfátové anionty (PO4-3) a kyanid (CN-1), napsaný v tomto pořadí, a olověný kation IV (Pb+4). Takže jeho vzorec je PbPO4CN.
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-sal-duplo.htm
