V každodenním životě a v laboratořích existují reakce a transformace, které jsou spontánní, a jiné, které nejsou spontánní. Například veškeré spalování je spontánní reakcí, protože jakmile se spustí, bude pokračovat, dokud se nespotřebuje veškeré palivo nebo dokud nezmizí veškerý kyslík.
Na druhou stranu je elektrolýza nespontánní proces, při kterém se elektrická energie transformuje na chemickou energii. Příkladem je elektrolýza chloridu sodného (NaCl). Když přes tuto roztavenou sůl prochází elektrický proud, dochází k redoxním reakcím a tvorbě kovového sodíku (Na(s)) a plynný chlor (Cl2 (g)). Pokud přestaneme napájet elektrický proud, reakce nebude pokračovat sama, což ukazuje, že to není spontánní.
Spontánnost reakce lze měřit pomocí Gibbs-Helmholtzova rovnice, Níže uvedené:

O tom, co:
∆G = variace volné energie;
∆H = změna entalpie;
T = teplota v Kelvinech (vždy kladná);
∆S = změna entropie.
Tato rovnice má svůj název, protože ji navrhl americký fyzik J. Willard Gibbs (1839-1903) a německý fyzik Hermann Helmholtz (1821-1894).
Abychom lépe pochopili, jak nám tato rovnice pomáhá určit spontánnost reakce, pojďme si krátce prohlédnout každý z pojmů v ní obsažených:
- ∆H (variace entalpie): Entalpie (H) je energetický obsah látky. Zatím není znám žádný způsob, jak to určit. V praxi se toho dosáhne měřením variace entalpie (∆H) procesu pomocí kalorimetrů. Tato variace je množství energie, která byla v procesu uvolněna nebo absorbována.
- ∆S (variace entropie):Entropie (S) je termodynamická veličina, která měří stupeň poruchy v systému.
Například při tání ledu se molekuly pohybují z pevného do kapalného stavu, kde dochází k větší dezorganizaci. To znamená, že v tomto procesu entropie vzrostla (∆S> 0).
Při výrobě amoniaku (NH3), 1 mol plynného dusíku reaguje s 3 mol plynného vodíku (tj. 4 mol molekul v reaktantech), čímž vzniknou 2 mol amoniaku:
N2 (g) +3 H2 (g) → 2 NH3 (g)
Jelikož se v tomto procesu snižuje počet molekul v plynné fázi, snížila se dezorganizace, což znamená, že se také snížila entropie (∆S <0).
- ∆G (volná energie): Energie zdarma nebo Gibbsova volná energie (protože to navrhl až tento vědec v roce 1878) je užitečná energie systému, který se používá k práci.
Systém má globální energii, ale jen zlomek této energie bude použit k práci, toto se nazývá Gibbsova volná energie, symbolizovaná G.
Podle Gibbse, proces je považován za spontánní, pokud vykonává práci, tj. pokud G klesá. V tomto případě bude konečný stav transformace stabilnější než počáteční stav, když ∆G <0.
Na základě toho můžeme učinit závěr:

Můžeme také zjistit, zda bude proces spontánní, když se podíváme na algebraické znaménko ∆H a ∆S v Gibbs-Helmholtzově rovnici:
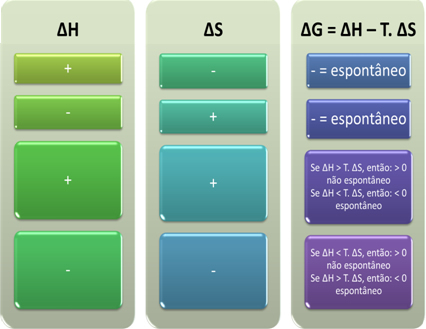
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm
