Reakce posunutí, také zvaný substituční reakcenebo stále z jednoduchá výměna, jsou ty, ke kterým dochází, když jednoduchá látka (tvořená jediným prvkem) reaguje se sloučeninou a „přemístí“ ji na novou jednoduchou látku.
Obecně to můžeme definovat takto:
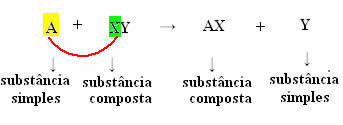
Ale aby se to stalo, jednoduchá látka, v případě symbolizovaném A, musí být reaktivnější než prvek, který bude přemístěn ze sloučeniny, transformující se do nové jednoduché látky (Y).
Podívejme se na příklad, kde k této reakci dochází:
Sledujte experiment níže, ve kterém je vrstva zinku (Zn) umístěna do vodného roztoku síranu měďnatého (CuSO)4). Postupem času je třeba poznamenat, že roztok síranu měďnatého se mění z modré barvy na méně intenzivní modrou, protože se zbarvil a na zinkovém plechu byla usazenina mědi.

Tuto reakci můžeme reprezentovat pomocí následující chemické rovnice:

Všimněte si, že zinek vytlačil měď, což znamená, že zinek je nejreaktivnější.
Jelikož oba jsou kovy, můžeme zkontrolovat, zda k jednoduché výměnné reakci dojde, či nikoli analýzou fronta reaktivity kovů je uvedeno níže:

Mějte na paměti, že měď je ve skutečnosti méně reaktivní než zinek, takže pokud jsme se rozhodli udělat opak předchozího experimentu a vložte měděný plech do roztoku síranu zinečnatého, reakce by nenastala, protože měď by nemohla vytěsnit zinek.
Vytěsňovací reakce jsou typem redoxní reakce, protože dochází k přenosu elektronů z jednoduché látky do kompozitu. Ve výše vysvětleném procesu byl zinek původně ve své neutrální formě, která je kovová, a se stala součástí sloučeniny, ve které má náboj 2+, to znamená, že každý atom zinku ztratil dva elektrony. U mědi se stane pravý opak, přijme dva elektrony, které přejdou do kovového pevného stavu.
V případě jednoduché výměnné reakce s nekovy se uvažuje: reakce proběhne pouze v případě, že nejreaktivnějším nekovem je jednoduchá látka, která může vytlačit další méně reaktivní nekov. Reaktivita kovů je uvedena níže:

Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/reacoes-deslocamento-substituicao-ou-simples-troca.htm
